NOTION DE COUPLE ACIDE/BASE
DEFINITIONS
Un système chimique est en
équilibre si les concentrations molaires de ses constituants restent constantes
au cours du temps.
Exemple:
CH3COOH + H2O ⇆ CH3COO-
+ H3O+
La double flèche représente le caractère réversible de la réaction.
Cet état est un équilibre chimique,
c.-à-d. commune à deux réactions inverses l’une de l’autre et se limitant
mutuellement.
Couple acide/base
Lorsqu’un acide libère un
proton, l’espèce engendrée lors de l’opération est une base et on écrit :
Acide ⇆ base + H+.
De même, lorsqu’une base capte un proton, l’espèce engendrée est un acide et on
peut écrire :
Base + H+ ⇆ acide.
Les espèces conjuguées acide et base forme un couple qu’on note acide/base.
Un couple acide/base est constitué de deux espèces chimiques conjuguées,
qui échangent un proton H+ suivant le schéma :
Acide ⇆ Base + H+
(définition de Brönsted)
Dans un couple acide/base, l’acide se note avant la base.
Exemple : L’acide
éthanoïque et l’ion éthanoate forment un couple noté : CH3COOH/CH3COO-
SOLUTIONS ACIDES
Constante d’acidité
On appelle constante d’acidité,
notée KA , la constante d’équilibre
associée à l’équation de la réaction d’un acide et de l’eau.
L’équation
générale acido-basique s’écrit :
Acide + H2O ⇆ Base +H3O+
La constante d’acidité associée à cette équation
s’écrit :
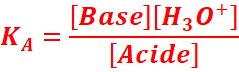
KA qui
est un nombre sans dimension ne dépend que de la température.
Les valeurs de KA ainsi obtenues dont petites : Il
est donc commode d’utiliser une autre grandeur notée pKA
et définie par :
pKA=-logKA ou KA=10-pKA
Relation
entre le pH et le pKA :
pKA=-log [Base][ [H3O+] /[Acide]=-log![]() - log[Base]/[Acide]=>
- log[Base]/[Acide]=>
pH=pKA
+ log [Base]/[Acide]
Exemple : Pour le couple CH3COOH/CH3COO-
,
On donne : Ca=10-2 mol.l-1, [CH3COO-] = 4.10-4 et [H3O+]
=4.10-4
![]() =
=![]()
En général
pour un acide, on a :
AH +H2O ⇆ A-
+H3O+.
=> 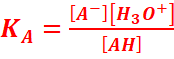
SOLUTIONS
BASIQUES
Constante de basicité
Considérons maintenant la réaction de dissociation d’une base dans
l’eau. La constante d’équilibre de cette réaction est appelée constante de
basicité :
B +H2O ⇆BH+ + HO-
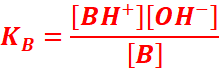
C’est une autre caractéristique d’un couple acide/base et sa valeur dépend
de la température du milieu. On définit le pKb
du couple acide/base :
pKB = -
log (KB)
Relation
entre la constante d’acidité et la constante de basicité
La constante de basicité est liée à la constante d’acidité du couple :
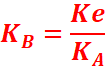
On a
alors :
pKB +pKA =pKe
Remarque : KB n’est pas
couramment utilisé en Chimie.
CLASSIFICATION
DES COUPLES ACIDE/BASE
Cas des acides
-Un acide est d’autant plus fort que son pH est petit.
-Un
acide est d’autant plus fort que la constante d’acidité de son couple
acide/base est plus grande (et donc que son pKA
est plus petit).
Cas des bases
-Une base est d’autant plus forte que le pH de sa solution aqueuse est
grand.
-Une
base est d’autant plus forte que la constante d’acidité de son couple
acide/base est plus petite (et donc que son pKA
est plus grand).
Conséquences : Plus un acide est
fort, plus sa base conjuguée est faible
Plus une base est
forte, plus son acide conjugué est faible.
EXERCICES
EXERCICE
I :
1-On
donne les demi-équations acido-basiques suivantes :
H3O+
⇆ H2O + H+
HO- + H+
⇆ H2O
a.
Identifier à partir ces demi-équations les couples de l’eau.
b.
Justifier pourquoi on dit que la molécule d’eau est un amphotère.
2-La
réaction du chlorure d’hydrogène avec l’eau est :
HCl +H2O→H3O+ + Cl-
a-Identifier le couple acide-base du chlorure
d’hydrogène.
b-Pourquoi dit-on que cette réaction est totale ?
EXERCICE
II:
La
mesure à 25 C du pH d’une solution d’acide éthanoïque de concentration C=1,0.10-2
mol.l-1 a donné pH=3,4.
1.Determiner
la valeur de l’expression ![]()
2.En
déduire la valeur du pKA du couple CH3COOH/CH3COO-
3.Calculer
le pKA de l’acide méthanoïque de même
concentration(pH=2,9).
Comparer
les deux acides.
EXERCICE
III:
Pour
préparer 100 ml de chlorure d’ammonium (NH4Cl), on dissout 0,32 g de
solide dans l’eau. La solution obtenue a alors un pH=5,2 à 25 C.
1.Ecrire
l’équation d’ionisation de ce composé.
2.Calculer
la concentration initiale en ion ammonium. Montrer que l’ion ammonium est un
acide faible.
3.Ecrire
l’équation bilan de la réaction entre l’ion ammonium et l’eau.
4.Le
couple NH4+/NH3 a pour pKA=9,2.
4.1.
Définir la constante d’équilibre de cette réaction.
Déterminer sa valeur numérique.
4.2.
Déterminer les espèces chimiques majoritaires dans la solution.
.
EXERCICE IV :
L’équation-bilan
de la réaction entre l’ammoniac (Cb=1,0.10-2 mol/l ; pH=10,6) avec l’eau s’écrit :
NH3 +
H2O → NH4 + + OH-
1.
Identifier le couple acide-base mis en jeu.
2.Calculer
la constante de basicité de ce couple
3.En
déduire sa constante d’acidité et son pKA.
4.Comparer
l’ammoniac a une solution de NaOH de même
concentration(pH=12).
Conclure
EXERCICE
V :
Le collège LES COMPETENTS a reçu des flacons d’acides
carboxyliques identiques de concentration C=0,10moL/L nécessaire à la
réalisation des T.P. Sur l’étiquette de chaque flacon le nom et la formule de
l’acide carboxylique m’apparaissent pas malheureusement.
Les élèves de terminale D se répartissent en deux groupes afin d’identifier
l’acide organique présent dans les flacons tout en vérifiant la conformité du
titre molaire (C=0,10moL/L) de ces solutions.
Opérations effectuées par le groupe 1 :
• Introduction dans un bécher d’un volume Va=20 mL
de la solution d’un flacon.
• Dosage pH-métrique de 20 mL de cette solution
d’acide carboxylique qu‘on notera AH par une solution d’hydroxyde de
sodium (Na++OH−) de concentration Cb=0,2 moL/L
Opérations effectuées par le groupe 2 :
• Analyse qualitative et quantitative des espèces présentes dans la solution du
bécher au moment où le groupe 1 a fait couler un volume Vb de la solution dosante.
• Recherche du pKa du couple auquel
appartient l’acide AH.
Résultat obtenu au cours du dosage par le groupe 1 :
Volume versé de la solution basique à la demi-équivalence
: Vb12(eq)=5 mL.
Quelques résultats en moL/L
:
[H3O+]=1,41×10−4, [AH]=0,054, [Na+]=0,023
Autres données :
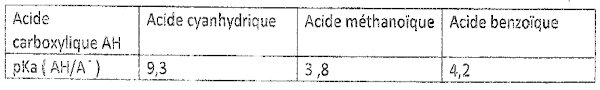
En exploitant les informations ci-dessus et à l’aide
d’un raisonnement scientifique,
l. Rassure toi que le titre molaire (C=0,1moL/L) des solutions reçues
est exact.
2- Poursuit la démarche entreprise par le groupe Il et identifie l’acide
carboxylique présent dans les flacons.
CORRIGES
EXERCICE I :
1.a
H3O+ ⇆ H2O + H+ =>couple H3O+/H2O
HO - +H+⇆H2O =>couple H2O/HO-
b.
L’ion H3O+ qui peut céder un proton H+ est un
acide. Sa base conjuguée est la molécule d’eau.
L’ion HO- qui peut capter un proton H+ est une base, son acide
conjugué est la molécule d’eau.
La molécule d’eau qui se comporte tantôt comme un acide et tantôt
comme une base est un amphotère ou ampholyte.
2-a- couple HCl/Cl-
b-Le chlorure
d’hydrogène est complètement ionisée. On ne retrouve plus les molécules de HCl dans la solution.
//la base conjuguée d’un acide fort est une espèce chimique
indifférente dans l’eau.
EXERCICE II :
CH3COOH + H2O ⇆ CH3COO-
+ H3O+
1.Valeur de l’expression 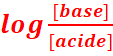
[H3O+]=10-pH=10-3,4
[CH3COO-]≈[H3O+]=10-pH=10-3,4
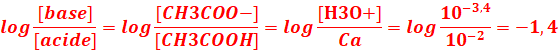
2.En déduire la valeur du pKA du couple CH3COOH/CH3COO-
pH=pKA + log [Base]/[Acide]
=>pKA=pH- log [Base]/[Acide]=3,4+1,4 = 4,8
3.HCOOH→HCOO- + H3O+
[H3O+]=10-pH=10-2,9
pKA=pH-
log [Base]/[Acide]=2,9-log10-2,9/10-2=2,9+0,9=3,8
A
la même concentration, l’acide méthanoïque(pKA=3,8)
est plus fort que l’acide éthanoïque(pKA=4,8).
EXERCICE III:
1.Equation d’ionisation de NH4Cl dans l’eau.
NH4Cl → NH4+ + Cl-
2.Calcul de
la concentration initiale en ion ammonium.
[NH4+]=n/V=m/MV=0.32/(14+4+35,5)x0,1=0.06 mol.l-1
Montrons que l’ion ammonium est un acide faible.
[H3O+] =10-pH=10-5,2=6,3.10-6
mol.l-1.
[H3O+]<<[NH4+]=>[NH4+] est un acide
faible
3.Ecrire l’équation bilan de la réaction entre l’ion ammonium et
l’eau.
NH4+
+ H2O → NH3 + H3O+
4.Le couple NH4+/NH3 a pour pKA=9,2.
4.1. Constante d’équilibre de cette réaction.

pKA=9,2.=> KA=10-9,2=6,3.10-10
4.2. Majoritaires : NH₄⁺, H₂O ; Minoritaires : NH₃, H₃O
//Cl- est un ion spectateur
EXERCICE
IV :
1. Identifier le couple acide-base mis en jeu
La réaction :
NH₃ + H₂O ⇌ NH₄⁺ + OH⁻
→ Le couple acide/base est : NH₄⁺ / NH₃
- NH₃ : base
(capte un H⁺)
- NH₄⁺ : acide
(donne un H⁺)
2. Calculer la constante de basicité Kb
On donne :
- Cb = 1,0 × 10⁻² mol/L
- pH = 10,6 → pOH = 14 - 10,6 =
3,4
- Donc : [OH⁻] = 10⁻³.⁴ ≈
3,98 × 10⁻⁴
mol/L
À l’équilibre :
- [NH₄⁺] = [OH⁻] = x ≈ 3,98 × 10⁻⁴ mol/L
- [NH₃] ≈
Cb - x ≈ 1,0 × 10⁻² mol/L
(x petit donc négligeable)
Kb = [NH₄⁺][OH⁻] / [NH₃]
Kb ≈ (3,98 × 10⁻⁴)² / (1,0 ×
10⁻²) ≈
1,58 × 10⁻⁵
3. Déduire Ka et pKa
On utilise : Ka × Kb = Ke = 1,0 × 10⁻¹⁴
Donc :
- Ka = Ke / Kb = (1,0 × 10⁻¹⁴) / (1,58 × 10⁻⁵) ≈ 6,33 × 10⁻¹⁰
- pKa = –log(Ka)
≈ –log(6,33 × 10⁻¹⁰) ≈ 9,2
4. Comparaison avec NaOH
- Ammoniac (1,0 × 10⁻² mol/L) : pH = 10,6
- NaOH (1,0 × 10⁻² mol/L) : pH ≈ 12
→ NaOH est une base forte,
totalement dissociée
→ NH₃ est une
base faible, partiellement protonée
EXERCICE V :
1- Il est question de se rassurer du titre
molaire des solutions reçues.
Étapes :
• Écrire l'équation-bilan de la réaction support du dosage ;
• Déterminer le volume de la solution basique versé à l'équivalence ;
• Déterminer la concentration Ca de
la solution d’acide dosée ;
• Comparer la concentration Ca à C ;
• Conclure.
Résolution :
Équation-bilan de la réaction :
AH+OH−→A−+H2O
Volume de base versé à l'équivalence : VbE=2VbE12=10 mL
Détermination de Ca
A l'équivalence on a :
nAH=nHO−⇒ CaVa=CbVbE
Ca=CbVbE/Va=0,1 mol/L
Comparaison : On constate que Ca=C.
Conclusion : Le titre molaire des solutions reçues est bel et bien exact.
2- Identification de l'acide carboxylique
présent dans les flacons.
Étapes :
• Déterminer la concentration en ions hydroxyde [HO−];
• Écrire l’équation d’électroneutralité (E.B.N) ;
• Déterminer la concentration des ions A− ;
• Déterminer le Ka;
• Déduire le pKa;
• Retrouver sur le tableau le nom de l’acide AH correspondant
au pKa trouvé.
Résolution :
Ke=[H3O+].[HO−] ⇒[HO−]=Ke[H3O+]=7,1×10−11 mol/L
EEN : [N+a]+[H3O+]= [HO−]+[A−]⇒[A−]= [N+a]+[H3O+]
Car [HO−]≪[H3O+]
[A−]=0,0231 mol/L
Ka=[H3O+][A−][AH]
AN : Ka=6,03×10−5.
pKa=−log(6,03×10−6)=4,2
En observant le tableau, on constate que l'acide faible correspondant à
ce pKa est
l’acide benzoïque.
L'acide présent dans les flacons est donc l'acide benzoïque.
Merci de votre visite
Laissez un commentaire