LES
SOLUTIONS AQUEUSES
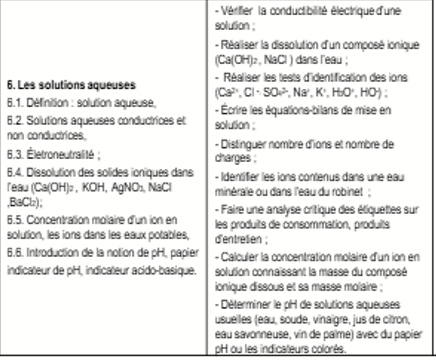
DEFINITIONS
Solution
aqueuse
. Une solution aqueuse est un
mélange homogène d’un soluté et d’un solvant qui est l’eau.
-Le soluté est le corps qu’on dissout.
-Le solvant est le corps qu’on utilise pour dissoudre.
Exemple : une solution salée a du sel comme soluté et de l’eau comme solvant.
DISSOLUTION DES SOLIDES
IONIQUES
La dissolution d’un composes
ionique solide dans l’eau sépare les deux types d’ions dont il est
constitué :
-les ions charges
d’électricité positive ou cations
-les ions charges
d’électricité négative ou anions.
Le compose ionique solide ne
porte pas de charge électrique : on dit qu’il est électriquement neutre. La solution aqueuse obtenue lorsqu’il est
dissous dans l’eau est aussi électriquement neutre.
Exemple :
Dissolution du chlorure de sodium dans l’eau (NaCl).
NaCl → Na+ +Cl-
Dans la solution obtenue,
il y a des ions Na+ et Cl-
Concentration massique Cm
C'est le rapport de la
masse d’un composé X contenu dans un certain volume de solution divisée par ce
volume de cette solution.
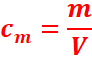
La masse m est exprimée en gramme(g)
Le volume V souvent exprimé en litre(l) .
La concentration Cm en gramme par
litre(g/l)
Exemple
On dissout 5 g de sulfate de cuivre (CuSO4) dans 400 ml d’eau. Quelle
est alors la concentration massique du sulfate de cuivre ?
On a:
m(CuSO4)=5g,
V=400ml
cm= m(CuSO4)/V=5/0,4=12,5g/l\
Concentration molaire d’une solution
On appelle concentration molaire d’une solution la quantité
(en moles) de soluté dissout dans un litre de solution.
Soit n le nombre de moles de soluté introduit dans l’eau
pour obtenir un volume V de solution, la concentration de la solution obtenue
est :
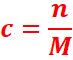
n : la quantité de matière
de A en solution en mole (mol)
V : volume de la solution en litre(l).
C : concentration molaire en môle par
litre (mol/l)
Exemple
Déterminer
la concentration d’une eau salée obtenue en dissolvant 0,6g de chlorure de
sodium dans l’eau et en complétant le volume a 200 cm3.
On
donne les masses molaires atomiques :Na :23 ; Cl :35,5
MNaCl=23+35,5=58.5 g/mol
V=0,2 l
n=0.6/58,5=0,01mol
C=
n/V=0,01/0,2=0,05 mol.l-1
NB : les chimistes
utilisent parfois les adjectifs molaire, decimolaire,
centimolaire….pour caractériser des solutions de concentrations
1mol.l-1 ;0,1mol.l-1 ;0,01mol.l-1…
Concentration molaire d’une espèce en
solution
La concentration
molaire d’une espèce chimique A en solution notée [A] est la quantité de
matière de cette espèce présente dans un litre de solution.
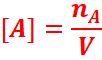
nA : la quantité de
matière de A en solution en mole (mol)
V : volume de la solution en litre(l).
[A] : concentration molaire en môle
par litre (mol/l)
Exemple : On dissout 0,585 g de NaCl
dans 100 ml d’eau. Calculons les concentrations molaires de chaque espèce en
solution.
NaCl → Na+ +Cl-
1mol 1mol 1mol
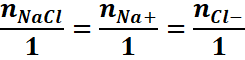
En
divisant partout par V, on obtient
[Na+]=[Cl-]=[NaCl] or
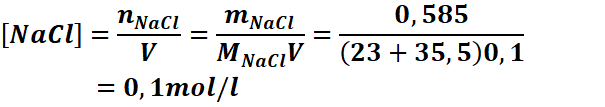
Donc [Na+]=[Cl-]= 0,1![]()
NEUTRALITE ELECTRIQUE D’UNE SOLUTION
Une solution aqueuse ionique a une charge
électrique totale nulle : il y a autant de charges positives que de
charges négatives. On dit qu’elle est électriquement
neutre. Ceci se traduit par une équation d’électroneutralité.
Exemples :
·
Soit
l’équation : NaCl → Na+
+Cl-
La neutralité permet d’écrire :
[Na+]=[Cl-]
·
Soit
l’équation : Al2(SO4)3 →
2Al3+ + 3SO42-
La
neutralité permet d’écrire :
3[Al3+]=2[SO42-]
IDENTIFICATION DES IONS
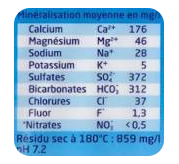
CONTENUS DANS L’EAU MINERALE
On trouve, dans les eaux
minérales, des ions assurant un apport en éléments indispensables à notre
organisme. Les étiquettes collées sur les bouteilles d'eau minérale donnent
plusieurs indications comme la nature des ions présents, leur concentration
massique et le pH de l'eau.
On peut mettre en évidence
la présence d’un ion dans la solution en ajoutant quelques gouttes d’un réactif
spécifique de chaque ion dans quelques millilitres de solution.

IV-PH DES SOLUTIONS
AQUEUSES
pH DES SOLUTIONS
AQUEUSES
Toute solution aqueuse contient des ions H3O+. Les
propriétés acides ou basiques d’une telle solution dépendent de la
concentration molaire en ions H3O+. Cette concentration
généralement faible, s’exprime en puissances négatives de 10.
Définition
Le pH (potentiel hydrogène) est une grandeur sans unité
associée à la concentration des ions H3O+
Elle permet de classer les solutions aqueuses.
A 25 C, son échelle va de 0 à 14.
Ainsi :
pH<7 la solution est
acide
pH=7 la
solution est neutre
pH>7 la solution est
basique
Mesure du pH
a. Indicateur coloré
Un indicateur coloré est
une espèce chimique qui change de couleur en fonction de la valeur du pH.
Par exemple, le BBT est un indicateur
coloré qui est bleu en milieu basique, vert en milieu neutre, et jaune en
milieu acide.
Si l'on introduit quelques gouttes de BBT dans une
solution aqueuse, celle-ci prend une teinte que l’on compare à une échelle de
teinte (qui sert de référence).
Introduire quelques gouttes d’un indicateur coloré dans une solution permet
donc de déterminer l’ordre de grandeur de son pH, mais pas la valeur précise du
pH.

b. Mesure au papier pH
Le papier pH est une bande
de papier imbibée d’un indicateur universel.
L’indicateur universel est constitué d’un mélange d’indicateurs colorés dont
les teintes varient graduellement en fonction du pH. Le papier pH a donc une
teinte qui varie en fonction de la valeur du pH.
Le papier pH se présente sous la forme de bandes étroites de papier. L’échelle
des teintes de l’indicateur en fonction du pH est imprimée sur le boitier.


En déposant une goutte de solution (de pH inconnu) sur
un morceau de papier pH, on détermine une valeur approximative de la valeur du
pH en comparant la couleur obtenue avec celle de l’échelle.
c. Mesure au pH-mètre

On peut mesurer la valeur du pH avec un pH-mètre.
Le pH-mètre est un appareil de mesure constitué d’une électrode
double reliée à un boitier électronique indiquant la valeur du pH.
Avant utilisation, le pH-mètre doit être étalonné avec deux solutions tampons.
Une solution tampon est une solution dont le pH est
stable et connu avec précision.
On étalonne le pH-mètre avec une solution tampon de pH
= 7,0 (pH neutre), puis avec une solution tampon acide (4,0) ou basique (9,0).
Une fois étalonné, on rince l’électrode, et on la plonge dans la solution
aqueuse dont on cherche à déterminer le pH.
La lecture du pH se fait sur l’écran du boitier électronique.
EXERCICES
EXERCICE I :
On
dissout dans l’eau 8 g de soude de formule NaOH dans
100 ml d’eau.
1-Ecrire l’équation de dissolution de la soude dans
l’eau
2-Calculer la masse molaire de la soude
3-Calculer la concentration massique de la soude dans
cette solution.
4-Calculer la concentration molaire de la soude dans
cette solution.
On donne : Na :23 ; O :16 ; H :1
EXERCICE II :
On dissout 0,740g de l’hydroxyde de
calcium Ca (OH)2 dans 100 ml d’eau.
1.Ecrire l’équation de dissolution de l’hydroxyde de
calcium dans l’eau.
2.Calculer les concentrations molaires de chaque
espèce dans la solution obtenue.
3.En déduire l’équation d’électroneutralité.
On donne : Ca :40 O :16 ; H :1
EXERCICE III :
1.Définir : indicateur acido-basique
2.Ecrire les formules des ions suivants : ion
hydronium, ion sodium, ion sulfate.
Lequel de ces ions est monoatomique ?
3.On dissout 5,6 g de chlorure de calcium dans 100 ml
d’eau. L’équation de mise en solution est :
CaCl2→Ca2+ + 2Cl-
3.1-Nommez les ions contenus dans cette solution.
3.2-Calculez la concentration de chacun des ions
présents dans cette solution
On donne :
Ca :40 Cl :35,5
EXERCICE IV :
Tu veux identifier certains ions présents dans une
bouteille d’eau minérale. Tu prélèves quelques millilitres que tu introduis
dans trois tubes à essais au numéro 1,2 et 3
-Dans le tube 1 on y ajoute du nitrate d’argent et il
se forme un précipité blanc qui noircit à la lumière.
-Dans le tube 2 on y ajoute un peu de nitrate de
baryum et on observe un précipité blanc qui se forme.
-Dans le tube 3 on y ajoute un réactif d’ion oxalate
et il se orme un précipité orange.
En interprétant les résultats des tests ainsi
effectues, quels ions trouve-t-on dans cette bouteille d’eau minérale ?
EXERCICE V :
On donne le tableau suivant :
|
Solution |
Eau de javel |
Jus d’orange |
Bile |
Lait |
|
pH |
11,5 |
3,8 |
7 |
6,6 |
1.Quelle est la solution la plus acide ?
2.Quelle est la solution la plus basique ?
3.Quelle est la solution neutre ?
4.Classer les solutions par ordre d’acidité
croissante’
EXERCICE VI :
Dans le laboratoire de
chimie de votre établissement, l'humidité et la moisissure ont endommagé les
étiquettes de trois flacons, les rendant ainsi non-identifiables. Les trois
flacons contiennent des solutions aqueuses différentes : une solution de chlorure
de sodium (contenant les ions sodium et les ions chlorure), une solution de
sulfate de calcium (contenant les ions calcium et les ions sulfate) et une
solution d'hydroxyde de sodium (contenant les ions sodium et les ions
hydroxyde).
Il vous est demandé d’étiqueter chacun les trois flacons.
Vous donnerez : le matériel nécessaire, les éventuels schémas des dispositifs
expérimentaux à utiliser ainsi que les modes opératoires correspondant.
Vous soignerez votre présentation. (BEPC 2020)
EXERCICE VI :
Depuis quelques jours, Mme Donfack manque d'appétit et est toujours fatiguée. Il lui a
été prescrite comme boisson une eau sans sel c'est à dire dépourvue des ions
chlorure et des ions sodium. Les résultats d'analyse de son sang viennent de
IUI parvenir mais malheureusement elle ne peut pas les interpréter. Elle
sollicite ton aide :

Information : Un excès de
créatinine provoque une insuffisance rénale.
En exploitant tes connaissances et en effectuant des calculs,
1-Montre comment vérifier à partir des résultats des tests que l'eau qu'elle
consomme respecte la prescription (sans ions chlorure et des ions sodium)
2-Dire si les soucis de santé de Mme Donfack
proviennent du dysfonctionnement de ses reins.
Masses
molaires atomiques : C :12 ; H :1 O :1 6 N : 14
CORRIGES
EXERCICE I :
1-NaOH →
Na+
+ HO-
2-M=MNa
+MH+MO =23+1+16=40 g/mol
3-C=m/V=8/0,1=80g/l
4-C=n/V=m/MV=8/40x0,1= 2 mol/l // car
n=m/M
EXERCICE II :
On dissout 0,740g de
l’hydroxyde de calcium Ca(OH)2 dans 100 ml d’eau.
1. Ca(OH)2 → Ca+ +2HO-
2.Soit c la concentration du Ca(OH)2 dans l’eau. C=n/V=m/MV=0,740/74x0,1=0,1mo/l
Ca(OH)2 → Ca+ +2HO-
1 mol 1mol 2mol
![]() //En divisant partout par le volume
//En divisant partout par le volume
On obtient :
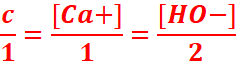
![]()
![]()
3. ![]()
EXERCICE III :
1. Un indicateur coloré est une
espèce chimique qui change de couleur en fonction de la valeur du pH.
2.Ecrire les formules des ions
suivants : ion hydronium, ion sodium, ion sulfate.
Ion hydronium: H3O+
Ion sodium:
Na+
Ion sulfate : SO4 2-
Ion monoatomique :Na+
3.On dissout 5,6 g de chlorure de calcium
dans 100 ml d’eau. L’équation de mise en solution est :
CaCl2→Ca2+ + 2Cl-
3.1-Ca2+ : ion calcium
Cl- : ion chlorure
3.2-concentration molaire c du chlorure de
calcium ; c=m/MV=5,6/111x0,1=0,5 mol/l
[Ca+]=c=0,5 mol/l
[Cl-]=2c=1mol/l
EXERCICE IV :
Tube 1 : ions chlorures
Tube 2 : ions sulfates
Tube 3 : ions calcium
EXERCICE V :
On donne le tableau
suivant :
|
Solution |
Eau de javel |
Jus d’orange |
Bile |
Lait |
|
pH |
11,5 |
3,8 |
7 |
6,6 |
1.Jus d’orange
2. Eau de javel
3. Bile
4. Eau de javel, Bile, Lait, Jus d’orange.
Avez-vous
un exercice a proposer?Cliquez-ici
Merci de votre visite
Laissez un commentaire