GENERALITES SUR LES SOLUTIONS AQUEUSES
DEFINITIONS
Solution
. Une solution peut être
définie comme un mélange homogène dont les constituants sont divisés et
dispersés l'un dans l'autre au niveau moléculaire.
·
Une solution est toujours constituée :
d'un solvant (constituant
majoritaire) : lorsque le solvant est l'eau la solution est dite aqueuse.
·
d'un ou plusieurs solutés :
Les solutés peuvent être :
-un gaz : CO2 dans les boissons gazeuses, O2, HCl…
-un liquide : éthanol, …
-un solide : sel.
La
concentration massique Cm
C'est le rapport de la
masse d’un composé X contenu dans un certain volume de solution divisée par ce
volume de cette solution.
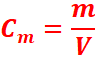
La masse m est exprimée en gramme(g)
Le volume V souvent exprimé en litre(l) .
La concentration Cm en gramme par
litre(g/l)
Exemple
On dissout 5 g de sulfate de cuivre (CuSO4) dans 400 ml d’eau. Quelle
est alors la concentration massique du sulfate de cuivre ?
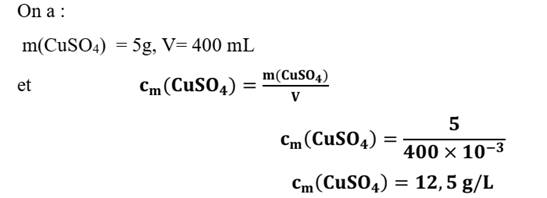
Concentration molaire d’une solution
On appelle concentration molaire
d’une solution la quantité (en moles) de soluté dissout dans un litre de
solution.
Soit
n le nombre de moles de soluté introduit dans l’eau pour obtenir un volume V de
solution, la concentration de la solution obtenue est :
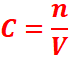
n : la quantité de matière
de A en solution en mole (mol)
V : volume de la solution en litre(l).
C : concentration molaire en môle par
litre (mol/l)
Déterminer la concentration d’une eau salée obtenue en dissolvant 0,6g
de chlorure de sodium dans l’eau et en complétant le volume a 200 cm3.
On donne les masses molaires
atomiques :Na :23 ;
Cl :35,5
MNaCl=23+35,5=58.5 g/mol V=0,2 l
n=0.6/58,5=0,01mol
C= n/V=0,01/0,2=0,05 mol.l-1
Remarque :
Les chimistes utilisent
parfois les adjectifs molaire, decimolaire, centimolaire…pour caractériser des solutions de
concentrations 1mol.l-1,0,1 mol.l-1,0,01mol.l-1…
Concentration d’une espèce en solution
La concentration
molaire d’une espèce chimique A en solution notée [A] est la quantité de matière de cette
espèce présente dans un litre de solution.
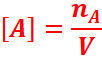
nA :
la quantité de matière de A en solution en mole (mol)
V : volume de la solution en litre(l).
[A]: concentration molaire en môle par
litre (mol/l)
Exemple : On dissout 0,585 g de NaCl
dans 100 ml d’eau. Calculons les concentrations molaires de chaque espèce en
solution.
NaCl → Na+ +Cl-
1mol 1mol 1mol
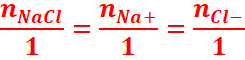
En
divisant partout par V, on obtient
[Na+]=[Cl-]=[NaCl] or
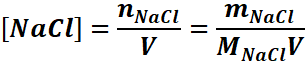
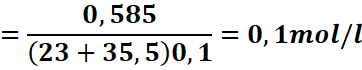
Donc
[Na+]=[Cl-]= 0,1![]()
PRODUIT IONIQUE DE L’EAU
Dans toute solution aqueuse, le
produit des concentrations molaires des ions H3O+ et HO-
à l’état d’équilibre et à une température donnée, est une constante appelée
constante d’équilibre d’autoprotolyse de l’eau.
Cette
constante notée Ke.
Ke est aussi
appelée produit ionique de l’eau.
Ke=[H3O+][HO-]
Ke est un nombre sans dimension qui dépend de la
température.
A 25°C, on a Ke =10-7.10-7=10-14
Le produit
ionique Ke étant une grandeur très faible, on lui
associe souvent une autre grandeur pKe telle
que :
pKe =
-logKe
Ainsi à 25°C, pour l’eau, on a Ke=10-14
d’où
pKe=-log10-14=
14
DEFINITION ET MESURE DU PH
Toute solution aqueuse contient
des ions H3O+ . Les propriétés acides ou basiques d’une
telle solution dépendent de la concentration molaire en ions H3O+.
Cette concentration généralement faible, s’exprime en puissances négatives de
10.
Définition : Le pH (potentiel hydrogène) est une grandeur sans unité
associée à la concentration des ions H3O+
Par la formule :
pH
=-log[H3O+] =10-pH <=>[H3O+]=10-pH
[H3O+] est exprimée en mol.l-1
Mesure du pH :
On peut
utiliser :
-utiliser un
pH-mètre
-utiliser le
papier pH
-utiliser
les indicateurs colorés
pH des solutions aqueuses
Toutes les solutions aqueuses (dans l’eau)
sont neutres, acides ou basiques.
a. Une solution neutre est obtenue quand la concentration des ions hydronium
est égale à la concentration d’ions hydroxyde :
[H3O+]
= [OH-]
b. Une solution acide est obtenue quand la concentration des ions hydronium est
supérieure la concentration d’ions hydroxyde :
[H3O+]
> [OH-]
c. Une solution basique est obtenue quand la concentration des ions hydronium
est inférieure la concentration d’ions hydroxyde :
[H3O+]
< [OH-]
. La plupart des concentrations
d’ions hydronium sont très faibles (c.-à-d. 4 × 10-8 mol/L ou 0,000 000 04
mol/L) d’où la proposition de potentiel d’hydrogène, l’échelle de pH par
Soeren Sorensen.
|
Le pH est une grandeur qui
permet de classer les solutions acides, basiques ou neutres. Une solution
aqueuse est : pH>7 <= >[H3O+]<[HO-]=>pH>1/2pKe
-Neutre si son pH = 7 : pH=7 <=>[H3O+]=[HO-]=>pH=1/2pKe -Basique
si son pH>7 : pH<7 <= >[H3O+]<[HO-]=>pH>1/2pKe |
Exemple :
Une solution de pH= 3 est une
solution acide dont la concentration molaire en ions H3O+
est [H3O+]= 10-3 mol.L-1
Remarques :
Plus le pH est élevé, plus la
concentration en ions H3O+ est faible et plus la solution
est basique
Plus pH est faible, plus la
concentration en ions H3O+ est élevée et plus la solution
est acide
ÉQUATIONS DE CONSERVATION
Neutralité électrique d’une solution
Une solution aqueuse
ionique a une charge électrique totale nulle : il y a autant de charges
positives que de charges négatives.
Par définition, lorsqu’une solution contient des ions Aa+, Bb+,….,Xx-,Yy- …l’équation qui traduit son électroneutralité s’écrit :
a[Aa+]+ b[Bb+]+…..=
x[Xx+]+y[Yy+]…
Exemple :
Soit
l’équation :
Al2(SO4)3 → 2Al3+ + 3SO42-
La
neutralité permet d’écrire :
3[Al3+]=2[SO42-]
·Conservation de la matière
C’est l’équation de la conservation
d’un élément ou groupe d’éléments au cours d’une réaction chimique. Elle varie
suivant que la réaction est totale ou limitée.
Exemple : Soit l’équation :
NaCl →
Na+ +Cl-
La concentration de la solution en NaCl
est :
C0=n0(NaCl)/V=n0(Na)=n0(Cl-)/V
Equation de conservation de la matière (ECM) :
C0=[Na+] = [Cl-]
EXERCICES
EXERCICE I :
On
dissout dans l’eau 8 g du sulfate de cuivre de formule CuSO4 dans
100 ml d’eau.
1-Ecrire l’équation de dissolution du sulfate de
cuivre dans l’eau.
2-Calculer la masse molaire du sulfate de cuivre.
3-Calculer la concentration massique du sulfate de
cuivre dans cette solution.
4-Calculer la concentration molaire du sulfate de
cuivre dans cette solution.
On donne : Cu :64 ; O :16 ; S :32
EXERCICE II :
On
dissout 0,01 mol de chlorure de calcium CaCl2 dans 250 cm3
d’eau.
1-Determiner la masse de chlorure de calcium
nécessaire.
2-La solution précédente est complétée a 500 cm3
avec de l’eau ; on obtient ainsi une solution de pH=7 à 25 °C.
a-Calculer les
concentrations molaires des ions ca2+ et Cl-.
b-Vérifier la
neutralité électrique de la solution et exprimer par une relation les
concentrations molaires [ca2+] et [Cl-].
EXERCICE III:
On dissout une masse m=20g de sulfate
aluminium Al2(SO4)3 dans 500 cm3
d’eau.
1-Calculer
la concentration molaire de chaque ion en solution.
2- Vérifier la neutralité électrique de la solution et exprimer par une
relation les concentrations molaires [Al3+] et [SO42-].
On donne les
masses molaires atomiques en g.mol-1 : Al=27. S=32.1 O=16
EXERCICE
IV:
1.Le pH du
café contenu dans une tasse est de 5,8 à 25 C. Calculer les concentrations
molaires des ions H3O+ et OH-.
2.A 25°C, un jus de tomate et une eau de lessive ont pour pH 4,1 et
11,2 respectivement. Pour chacune de ces solutions, calculer les concentrations
molaires en ions H3O+ et OH- .
3.Classer, par
ordre croissant de leur acidité, les solutions caractérisées à 25 C par :
a-pH=2,8
b-[HO-]=1,5=1,5.10-3
mol/l
c-[H3O+]=[HO-]
d-[H3O+]=0,045 mol/l
e-pH=8,3
EXERCICE V:
1.On dissout un volume V de chlorure d’hydrogène de concentration 1 mol/l
dans l’eau pure, pour obtenir 100 cm3 d’une solution chlorhydrique
de concentration 5.10-2 mol/l. Calculer le volume V.
2.On dissout 4g de cristaux d’hydroxyde de sodium dans 1l d’eau pure.
a-Calculer la concentration de la solution obtenue.
b-Quel volume d’eau pure doit-on ajouter à 5 ml de cette solution pour
obtenir une solution de pH =11 à 25 C ?
3-Une solution aqueuse de chlorure d’hydrogène, de concentration C=1.0.10-2mol/l,
a un pH=2 à 25. °C
a-Calculer les concentrations
molaires en ions H3O+ et OH- .
b-Quel volume de chlorure d’hydrogène HCl
a-t-il fallu dissoudre dans 500 ml d’eau pour obtenir cette solution, sachant
que dans les conditions de l’expérience, le volume molaire est 25 l/mol ?
c-Comparer C et [H3O+].La solution contient-elle
des molécules HCl ?
EXERCICE VI :
A 80°C , la valeur de pKe est
12,6.
1-Determiner la valeur du produit ionique de l’eau à
80 °C.
2-En déduire le pH de l’eau pure a cette
température.
3-A la même température, une solution aqueuse a un
pH=4,3. Calculer la concentration molaire des ions HO-.
EXERCICE VII:
La réaction entre l’ethanamine
(Cb=8,84.10-2 mol.l-1, Vb=6 ml)
et les ions H3O+ de la solution d’acide chlorhydrique(
Ca=10-1 mol.l-1,Va=10 ml)
a pour équation :
C2H5NH2 + H3O+ →
C2H5NH3+ + H2O
La solution obtenue a pour pH la valeur 1,5.
1.Identifier les espèces chimiques en solution
2.Ecrire l’équation de neutralité électrique. En
déduire la concentration des ions C2H5NH3+
3.Ecrire l’équation de conservation de la matière
pour l’élément azote. En déduire la concentration C2H5NH2
CORRIGES
EXERCICE I :
1. CuSO4 → Cu2+ + SO2-4
2.M(CuSO4) = 64+32+4x16=160
g/mol
3.C=m/V=8/0,1=80 g/l
4.n=m/M=8/160=0,05 mol
C=n/V=0,05/0,1=0,5 mol/l
EXERCICE II :
1-
M(CaCl2)=40+2x35,5=111g/mol
m/M=n
=>m=nM=0,01x111=1,11 g.
2-
a-
CaCl2→Ca2+
+2Cl-
1mol 1mol 2mol
C=[CaCl]=0,01/0,250=0,04
mol/l, V=250 cm3
C’V’ =CV =>C’=0,04x250/500=0,02
mol/l
![]()
<=
>
![]()
![]()
![]()
b- Neutralité électrique de la solution
![]()
EXERCICE III:
1-Equation
de mise en solution :
Al2(SO4)3
→2Al3+ + 3SO42-
1mol. 2mol. 3mol
![]()
![]()
![]() et
et ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 0,058 mol
0,058 mol
![]()
![]()
![]()
![]() 0,23 mol.l-1.
0,23 mol.l-1.
![]()
![]()
![]()
![]() 0,35 mol.l-1.
0,35 mol.l-1.
2-
La relation d’électroneutralité est : 3[Al3+]=2[SO42-]
EXERCICE
IV:
1.Calcul
des concentrations molaires des ions H3O+ et OH-.
[H3O+] =10-pH
=10-5,8= 1,58.10-6 mol/l.
Ke=[H3O+][HO-]=>[HO-]=ke/[H3O+]=10-14/1,58.10-6
=0,63.10-8 mol/l.
2.
Jus de
tomate
[H3O+]
=10-pH =10-4,1 = 7,94.10-5 mol/l.
Ke=[H3O+][HO-]=>[HO-]=ke/[H3O+]=10-14/7,94.10-5
=0,13.10--9mol/l.
Eau
de lessive
[H3O+]
=10-pH =10-11,2 = 6,31.10-12 mol/l.
Ke=[H3O+][HO-]=>[HO-]=ke/[H3O+]=10-14/6,31.10-12 =0,16.10--2mol/l.
3.
a-pH=2,8
b-[HO-] =1,5.10-3
mol/l =>[H3O+]=10-14/[HO-]=10-14/1,5.10-3=0,67.10-11
mol/l
=>pH=-(log0,67 +log10-11)=-(-0,1739-11)=11,17
c-[H3O+] =[HO-]=>pH=7
d-[H3O+]=0,045 mol/l =>pH=-log0,045=1,34
e-pH=8,3
Classement par ordre d’acidité
croissant : b, e, c, a, d
EXERCICE V:
1. Calcul du volume V.
C’V’=CV =>V= C’V’/C=100x5.10-2/1=5 ml.
2.
a-Calcul de la concentration de la solution obtenue.
NaOH→Na+ + HO-
M(NaOH)=23+16+1=40 g/mol
C=m/V=4/1=4g/l soit 4/40=0,1 mol/l.
b-
c=[Na+]=[HO-]
[H3O+]=10-11mol/l =>[HO-]=10-14/10-11=10-3
mol/l
C’V’=CV =>V’=CV/C’=5.10-3x0,1/10-3=0,5 l=500 ml.il faudra ajouter 500-5=495 ml d’eau.
3-
a-Calcul des
concentrations molaires en ions H3O+ et OH- .
[H3O+]=10-2
mol/l
[HO-]=10-14/10-2=10-12
mol/l
b-
n=V’/Vm=>
V’=nVm
n=CV=1.0.10-2x500.10-3=0,5.10-2
mol
V’=nVm=0,5.10-2x25=12,5. 10-2 l=125 ml.
c-
C=[H3O+] =>La solution ne contient plus de
molécule de HCl.
HCl est entièrement
dissociée en solution aqueuse.
EXERCICE VI :
1. pKe=-logKe =>Ke=10-pKe=10-12,6=2,51.10-13=0.251.10-14.
2. pH=1/2pKe=12,6/2=6,3
3.
[HO-]=Ke/[H3O+]=10-12,6 /10-4,3=10-8,3=5 .10-9mol/l
EXERCICE VII:
1.Espèces chimiques en
solution : C2H5NH2 ;
C2H5NH3+ ; H3O+ ;
HO- ; Cl-
2.Equation de neutralité électrique.
[C2H5NH3+] + [H3O+ ] = [HO-] + [Cl- ]
Concentration des ions C2H5NH3+
[H3O+
]=10-pH=10-1,5=3,16.10-2 mol.l-1.
[HO-]=10-14/3,16.10-2=10-12,5
mol.l-1.
[Cl-]=CaVa/V=10-1x10/16=0,0625
mol.l-1.
[C2H5NH3+] = [HO-] + [Cl- ] - [H3O+
] = 10-12,5 - 6,25.10-2 - 3,16.10-2=3,09.10-2
mol.l-1.
3.Equation de conservation de la matière
pour l’élément azote.
ninitial = nfinal+nreagi
[C2H5NH2
]V +
[C2H5NH3+] V=CbVb
Concentration C2H5NH2
[C2H5NH2
]= CbVb/V – [C2H5NH3+]
=8,84.10-2x6/16=3,315.10-2 - 3,09.10-2=0,225.10-2
mol.l-1.
Avez-vous
un exercice à proposer ? Cliquez-ici
Merci de votre visite
Laissez un commentaire