ELECTROLYSE ET SYNTHESE DE L’EAU
ELECTROLYSE
Expérience :
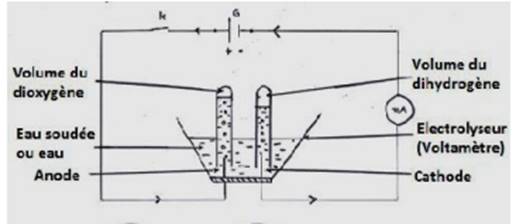
On réalise le dispositif constitué d’une cuve électrolytique,
des électrodes reliées a un circuit électrique alimenté par le générateurs G (schéma
de la figure ci-dessous). Deux tubes à essais plongent dans la cuve, l’un a l’anode,
l’autre à la cathode. Sachant que les tubes à essais sont remplis du même
liquide que celui de la cuve.
Observations :
·
Lorsque
l’interrupteur k est ouvert, on n’observe rien.
·
Lorsqu’on
ferme l’interrupteur K, on observe, le courant circule dans le circuit. On observe :
- des dégagements gazeux au niveau des électrodes,
- Le contenu
du tube de l’anode est à un niveau plus élevé.
Interprétation :
Le passage du courant électrique a conduit a conduit à
la formation de deux gaz :
-du
dioxygène a l’anode
-du
dihydrogène a la cathode
Mise en évidence des gaz formés :
·
La flamme
d’une buchette allumée se ravive lorsqu’on la présente à l’ouverture du
tube de gauche » le gaz formé dans ce tube est le dioxygène (O2).
·
Une légère détonation
est entendue lorsqu’on présente la buchette d’allumette a l’ouverture[H1] du tube de droite. Le gaz formé est le dihydrogène
(H2)
Définition :
L’électrolyse de l’eau est la
décomposition par le courant électrique de l’eau en deux gaz : le
dioxygène(O2) et le dihydrogène(H2).
L’équation de
cette décomposition de l’eau s’écrit :
2H2O→O2
+ 2H2
Le volume du dihydrogène est le double de celui du
dioxygène lors de l’électrolyse de l’eau ;
VH2=2VO2
SYNTHESE
DE L’EAU
Définition :
La synthèse de l’eau est la formation de l’eau à
partir du mélange réactionnel de dihydrogène et de dioxygène.
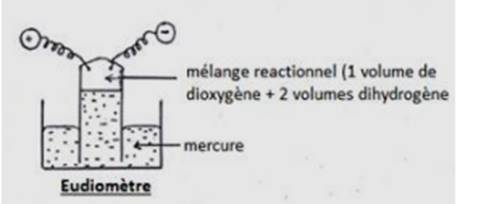
Expérience :
On retourne sur une cuve a mercure
une éprouvette contenant un mélange de dioxygène et de dihydrogène et comportant
un dispositif pouvant produire une étincelle.
Observation :
Après le passage de l’étincelle, les
gaz sont brulés et on observe :
-une diminution de pression qui se manifeste par la montée
du mercure dans l’éprouvette..
-une buée ou gouttelettes sur la paroi intérieure de
l’éprouvette. : c’est l’eau.
La combustion du dioxygène et du dihydrogène a
donc conduit à la formation de l’eau. L’équation bilan est :
2H2 + O2 → 2H2O
EXERCICES
EXERCICE I :
Lors d’une expérience sur l’électrolyse de l’eau, on a recueilli 480 cm3
de dihydrogène.
1- Sur quelle électrode a-t-on recueilli le gaz dihydrogène ?
2- Calculer le nombre de moles de dihydrogène recueilli.
3- Écrire l’équation bilan de cette réaction chimique.
4- Calculer la masse d’eau à décomposer.
On donne Vm
=24L.mol-1 ; MO = 16g.mol-1 ; MH = 1g.mol-1
EXERCICE
II :
1-Equilibrer l’équation suivante : H2O→H2+O2
2-Au cours d’une séance de travaux pratiques, on
réalise une expérience d’électrolyse de l’eau.
Le professeur fait arrêter l’expérience lorsque le volume
le plus important de gaz recueilli a l’une des électrodes atteint 20 cm3.
a-Faire le schéma annoté de l’électrolyseur.
b-Indiquer la valeur du volume de gaz recueilli à l’autre électrode.
c-Comment peut-on caractériser chacun de ces deux gaz ?
EXERCICE III :
Au cours d’une électrolyse de l’eau, on a recueilli
120 ml d’un gaz à la cathode.
1-De quel gaz s’agit-il ?
2-Comment l’identifie-t-on ?
3-Calcule le volume du gaz recueilli à l’autre
électrode.
EXERCICE IV :
Amadou utilise 80cm3 de dihydrogène et
35cm3 du dioxygène pour réaliser la synthèse de l’eau.
1. Quelle est le gaz
en excès ? justifier la réponse.
2. Détermine le volume du gaz restant.
3. Ecrit l’équation-bilan de la réaction.
CORRIGES
EXERCICE I :
1) On a recueilli le gaz dihydrogène sur
la cathode.
2) Nombre de moles de dihydrogène : n=VH2/Vm=0,480/24 =0,02 mol.
3) Équation bilan : 2H2O →
2H2 + O2
4) Masse d’eau à décomposer : Masse
molaire MH2O = (2 x 1) + 16 = 18g.mol-1
Nombre de moles Ainsi, nH2O/2=nH2
⇒ nH2O=0.02mol
nH2O=m/
MH2O =>m= nH2O x MH2O=0,02x18=0,36
g.
EXERCICE
II :
1- 2H2O→H2+O2
2-Au cours d’une séance de travaux
pratiques, on réalise une expérience d’électrolyse de l’eau.
Le professeur fait arrêter l’expérience lorsque
le volume le plus important de gaz recueilli a l’une des électrodes atteint 20
cm3.
a-
b-20/2=10cm3
c-
-une légère détonation est entendue
lorsqu’on approche une buchette allumée a l’ouverture du tube contenant du
dihydrogène.
-La flamme d’une
buchette allumée se ravive lorsqu’on la présente à l’ouverture du tube contenant
le dioxygène (O2).
EXERCICE III :
1-IL s’agit du dihydrogène
2- lorsqu’on approche à ce gaz une flamme,
il émet un bruit caractéristique
3- le volume du dioxygène
![]()
EXERCICE
IV :
1) le gaz
en excès
![]() .
.
![]() <
< ![]() donc le dihydrogène est en excès.
donc le dihydrogène est en excès.
2) Le volume restant
VH2rest=VH2-VH2rest=
avec VH2brute=2VO2
Donc
VH2 rest=VH2-2VO2=80-2x35=10cm3
3) Equation-bilan 2H2 + O2
→2H2O
Avez-vous
un exercice à proposer ? Cliquez-ici
Merci de votre visite
Laissez
un commentaire