LA REACTION CHIMIQUE
Définitions
Une réaction chimique
est une transformation au cours de laquelle des corps purs disparaissent et de
nouveaux corps purs apparaissent.
Un réactif un corps pur
qui est consommé au cours d’une réaction chimique.
Un produit est
un nouveau corps pur qui est formé au cours d’une réaction chimique.
Exemple :
Le carbone réagit avec
le dioxygène pour donner du dioxyde de carbone.
Réactif : carbone,
dioxygène.
Produit : dioxyde
de carbone.
La conservation de la matière au
cours d’une réaction chimique
· D’une
manière générale, au cours d’une réaction chimique, on retrouve dans les
produits d’une réaction les éléments constituants les réactifs. On dit qu’il y
a conservation des éléments.
· Les
atomes de chaque élément présent dans les réactifs se retrouvent donc, en
même nombre dans les produits : on dit qu’il y a conservation
des atomes. La conservation des atomes implique la conservation des
masses.
Loi de Lavoisier : Dans toute réaction
chimique la masse des produits est égale à celle des réactifs entrés en
réaction.
Remarques :
§ Lorsque qu’une transformation chimique
s’accompagne d’une augmentation de la température, la transformation est
dite exothermique ;
§ Lorsque qu’une transformation chimique s’accompagne
d’une diminution de la température, la transformation est dite endothermique ;
§ Si aucun effet thermique n’apparait lors d’une transformation
chimique, la transformation est dite athermique.
La représentation d’une réaction
chimique par une équation-bilan
On schématise une
réaction chimique par une équation-bilan. Pour écrire une
équation-bilan, on place dans le membre de gauche les formules des réactifs
séparées par le signe + et dans le membre de droite les formules des produits
également séparées par le signe +, les deux membres étant séparés par une
flèche indiquant le sens de la transformation chimique.
Ainsi, l’équation-bilan de la réaction entre le
fer et le soufre s’écrit :
Fe + S
→FeS
Ce qui se lit : le fer réagit avec le
soufre pour donner du sulfure de fer.
Une équation-bilan
n’est pas seulement une simplification d’écriture, mais un véritable bilan de
la réaction. Il est donc nécessaire que, dans l’écriture d’une équation bilan,
la conservation des atomes de chaque élément soit vérifiée.
Equilibrer
une équation bilan consiste
à placer, devant les formules des corps, des coefficients, appelés coefficients
stœchiométriques, de façon à exprimer la conservation de la matière.
Une équation bilan doit toujours être équilibrée.
Exemple : l’aluminium (Al) réagit avec du
soufre (S) pour donner du sulfure d’aluminium (Al2S3).
Al + S → Al2S3
|
Avant la
réaction |
Apres la
réaction |
|
Eléments :
Al ; S Nombre
d’atomes : 1 atome de Al 1 atome de S |
Eléments :
Al ; S Nombre
d’atomes : 2 atomes de Al 3 atomes de S |
Au premier membre de cette équation, on a 01
atome d’aluminium et 01 atome de soufre.
Au deuxième membre de cette équation, on a 02
atomes d’aluminium et 03 atomes de soufre. Donc cette équation n’est pas
équilibrée. Il faut donc multiplier par 2,
le nombre d’atomes d’aluminium et par 3 le
nombre d’atomes de soufre dans le premier membre. On obtient :
2Al + 3S → Al2S3
Utilisation d’une équation
bilan : La résolution d’un exercice de chimie
Pour résoudre un
exercice de chimie en utilisant une équation bilan :
- On écrit l’équation bilan équilibrée
de la réaction.
-On précise les quantités de matière
intervenant dans cette équation.
-Ensuite, on écrit la relation de
proportionnalité, à partir de laquelle on peut tirer les valeurs
recherchées.
·
Un mélange
est dit stœchiométrique si les réactifs sont pris dans les
proportions de l’équation-bilan équilibrée de la réaction.
·
Les
réactifs d’un mélange stœchiométrique sont entièrement
consommés et le milieu réactionnel ne comporte que les produits de la
réaction.
· D’une
manière générale, si les réactifs d’un mélange réactionnel ne sont pas dans des
proportions stœchiométriques, l’un d’eux se trouve en défaut : c’est le facteur
limitant du mélange. Il est entièrement consommé à la fin de la réaction.
On a en plus des produits formés, un reste du réactif en excès dans le mélange
réactionnel.
·
Dans
une réaction chimique, le réactif en défaut est celui qui s’épuise en
premier → il détermine la quantité de produit formé.
·
Le
réactif en excès est celui qui reste après la réaction.
Rendement d’une
réaction chimique
Le rendement indique si une
réaction chimique a produit autant de produit que prévu. Il permet de comparer
ce qu’on devrait obtenir (théoriquement) et ce qu’on obtient vraiment (en
réalité).
Formule (simplifiée) :
Rendement (%) = (quantité réelle
obtenue / quantité théorique attendue) × 100
Exemple :
Si on s’attend à obtenir 10 g
d’un produit mais qu’on n’en récupère que 8 g :
Rendement = (8 / 10) × 100 = 80 %
Cela signifie que la réaction a
été efficace à 80 %
EXERCICE I: Recopie et complète les phrases
suivantes :
1. Une réaction chimique est
une……………….au cours de laquelle des corps disparaissent et des corps
nouveaux……………..
2. Un …………..est un corps qui se
forme et apparaît au cours d’une réaction chimique.
3. Un…………. est un corps qui
disparaît au cours d’une réaction chimique.
4. Une réaction……………..est une
réaction chimique qui se produit avec un dégagement de chaleur.
5. Une réaction chimique se traduit
par une……………qui s’écrit en toutes lettres et dans laquelle n’interviennent que
les espèces réellement mises en jeux
EXERCICE II: Complète chacune des équations
littérales suivantes :
a)……………+……………→dioxyde de
carbone
b) Butane + dioxygène →………….+………….
c) Soufre + dioxygène→……………
EXERCICE III: On enflamme trois bougies. On
laisse la 1ère brulée à l’air libre, on enferme la deuxième dans un
flacon hermétique et on place la 3ème dans un flacon contenant du
dioxygène.
Observation 1 :la 1ère
bougie brûle, dégage la chaleur et ne s’éteint que lorsque toute la paraffine a
disparu.
Observation 2 :la 2ème
bougie cesse rapidement de brûler bien que la paraffine soit encore entière.
Observation 3 :la 3ème
bougie brûle intensément, dégage de la chaleur, se consume rapidement et ne
s’éteint que lorsque toute la paraffine
a disparu.
1.Pourquoi la première bougie brûle
–t-elle ?
2. Pourquoi la deuxième bougie cesse
de brûler ?
3. Pourquoi la troisième bougie
brûle rapidement ?
4. Quel corps est le responsable de
cette combustion ? Quel est son rôle ? Quel est le rôle de la
paraffine ?
5. Cette transformation est-elle une
transformation chimique ou physique ? Dis pourquoi ?
EXERCICE IV: Equilibre les équations bilans
suivantes :
1. ………H2
+ ………Cl2 →. ……..HCl
2………..Al +
…………S. →. ……..Al2S
3…………Fe +
………..O2 → ……….Fe2O3
4. Cu + O2 →.
Cuo
5. Cu2O
+ O2 → Cuo
6. H2S
+SO2 → H2O + S
7.C2H6O
+ O2 → CO2 + H2O
EXERCICE V:
Lors d’une combustion complète, 1,2
g de carbone réagit intégralement avec 3,2g de dioxygène.
1. Ecris l’équation-bilan de la
réaction
2. Calcule la masse du produit formé
3. Décris brièvement le test
d’identification du produit formé.
On donne : C :12 O :16
EXERCICE VI:
On fait réagir 56 g de limaille de
Fer sur 32 g de fleur de soufre à chaud et il se forme du sulfure de Fer (FeS).
1. Ecris l’équation bilan de la
réaction.
2. Calcule la quantité de matière de
chacun des réactifs.
3. Le mélange est-il
stœchiométrique ? sinon recherche le réactif par défaut.
4. Calcule la quantité de matière de
sulfure de Fer.
EXERCICE VII : Synthèse du chlorure de sodium
2Na + Cl₂ → 2NaCl
On fait réagir 4,6 g de Na (M = 23 g/mol) avec un excès de chlore.
On obtient 8,8 g de NaCl.
M(NaCl) = 58,5 g/mol
1. Quelle est la quantité de matière de Na ?
2. Quelle masse théorique de NaCl aurait dû se former ?
3. Quel est le rendement de la réaction ?
EXERCICE VIII:
L’équation chimique de la réaction entre l’aluminium et l’acide
chlorhydrique est :
2Al + 6HCl → 2AlCl₃ + 3H₂
On fait réagir 2,7 g d’aluminium avec un excès d’acide.
La quantité de dihydrogène obtenue est 0,045 mol.
Donnée : M(Al) = 27 g/mol
1. Calculer la quantité de matière d’Al.
2. Déterminer la quantité de H₂ attendue (théorique).
3. Calculer le rendement de la réaction
EXERCICE IX :
L’action du soufre sur l’aluminium donne du sulfure
d’aluminium Al2S3 .
2Al + 3S → Al2S3
1.Calculer la masse du
sulfure d’aluminium obtenu par action du soufre sur 5,4 g
d’aluminium.
2.En déduire la masse
de soufre utilisée.
EXERCICE
X :
Un
système chimique est constitué dans son état initial des espèces chimiques
suivantes : éthanol et chlorure d’éthanoyle.
A l’état final, il est constitué de
chlorure d’hydrogène, d’éthanoate d’éthyle et d’éthanol.
1. Quels sont les produits de la
réaction ?
2. Le chlorure d’éthanoyle est-il un
réactif ? Justifier la réponse
3.
On donne les formules suivantes :
Chlorure
d’éthanoyle : CH3COCl2
Ethanol :C2H5OH
Chlorure
d’hydrogène :HCl
Ethanoate d’éthyle :CH3COOC2H5
Ecrire l’équation
de cette réaction
CORRIGES
EXERCICE I:
1. Une réaction chimique
est une transformation au cours de laquelle des corps disparaissent et
des corps nouveaux apparaissent.
2. Un produit est
un corps qui se forme et apparaît au cours d’une réaction chimique.
3. Un réactif est
un corps qui disparaît au cours d’une réaction chimique.
4. Une réaction exothermique
est une réaction chimique qui se produit avec un dégagement de chaleur.
5. Une réaction chimique
se traduit par une équation qui s’écrit en toutes lettres et dans
laquelle n’interviennent que les espèces réellement mises en jeux
EXERCICE II:
a) Carbone+dioxygène…………→
dioxyde de carbone
b) Butane + dioxygène →Dioxyde
de carbone………….+…eau……….
c) Soufre + dioxygène→dioxyde
de soufre
EXERCICE III:
1. l’air libre apporte du
dioxygène nécessaire à la combustion de la bougie
2. Le dioxygène présent
initialement dans le flacon est tout consommé par la combustion.
3. Il y a beaucoup de
dioxygène.
4.Le dioxygène est
nécessaire pour les combustions d’ans l’air : c’est le comburant.
La paraffine est le
combustible
5. La mèche de la bougie
disparait au cours de la combustion. Il apparait de la fumée noire (carbone) et
du dioxyde de carbone : c’est une réaction chimique.
EXERCICE IV:
Equilibre les équations
bilans suivantes :
1.
H2 + Cl2 → 2HCl
2.
2Al + S → Al2S
3.
4Fe + 3O2 → 2Fe2O3
4.
2Cu + O2 → 2CuO
5.
Cu2O + ![]() O2 →
2CuO
O2 →
2CuO
6.
2H2S +SO2 → 2H2O + 3S
7.
C2H6O + 3O2 → 2CO2 + 3H2O
EXERCICE V:
1.
C +O2 ⇀CO2
1mol
1mol 1mol
2.
nC=nO2=nCO2
![]() mol-1
mol-1
MO2=16+16=32![]() mol-1
mol-1
![]() =
= ![]() =
=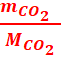 ó
ó 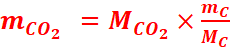 =
=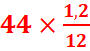 =4,4g.
=4,4g.
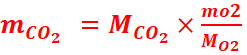 =
=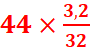 =4,4g.
=4,4g.
3. Il trouble l’eau de
chaux.
EXERCICE VI:
1. Fe +S⇀FeS
2. ![]() =
=![]() =
=![]() =1mol
=1mol
![]() =
=![]() =
=![]() =1mol
=1mol
3. oui
4. ![]() =
=![]() =
=![]() =1mol
=1mol
EXERCICE VII :
1.
n(Na) = 4,6 / 23 = 0,2 mol
2. 2
mol Na → 2 mol NaCl → donc :
n(NaCl)
= 0,2 mol → m(NaCl) = 0,2 × 58,5 = 11,7 g
3.
Rendement = (8,8 / 11,7) × 100 ≈ 75 %
EXERCICE
VIII :
1. n(Al) = 2,7 / 27 = 0,1
mol
2. D’après l’équation, 2 mol Al →
3 mol H₂
Donc :
0,1 mol Al → (3/2) × 0,1 =
0,15 mol (attendue)
3. Rendement = (0,045 / 0,15) × 100 = 30 %
EXERCICE
IX :
·
L’équation-bilan équilibrée
est : 2Al + 3S → Al2S3
·
On précise les quantités de matière intervenant dans cette
équation : 2mol 3mol. 1mol
·
· On
écrit la relation de proportionnalité :![]()
De cette relation, on a :
![]()

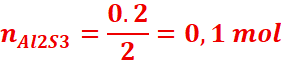
· Calculons
la masse de Al2S3
MAl2S3 =
2x27 +3x32=54+96=150g
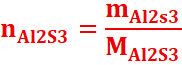
=>mAl2S3 =nAl2S3 xMAl2S3 =0,1x150=15g.
· Calculons
la masse du soufre
![]() =>
=>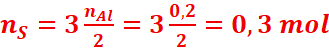
 => mS=nSxMS =
0,3x32=9,6 g
=> mS=nSxMS =
0,3x32=9,6 g
EXERCICE X :
1. Chlorure d’hydrogène,
éthanol et éthanoate d’éthyle.
2. Oui. Il résulte d’une réaction
chimique.
3. C2H5-OH + CH3COCl →HCl + CH3COOC2H5
Avez-vous
un exercice à proposer ? Cliquez-ici
Merci de votre visite
Laissez un commentaire