STRUCTURE DE QUELQUES
COMPOSES IONIQUES
Introduction
Les corps purs à l’état solide peuvent avoir :
-une structure atomique : un solide atomique
est un assemblage d’atomes.
-une structure moléculaire : un solide moléculaire
est un assemblage de molécules.
-une structure ionique : les particules
constituant le cristal sont des ions positifs et des ions négatifs.
STRUCTURE DU CHLORURE DE SODIUM
Le
chlorure de sodium est un cristal constitué d'ions sodium et d'ions chlorures.
Ce cristal ou réseau cristallin est formé de la répétition d'une même figure
géométrique appelée maille.
La
maille du chlorure de sodium est cubique à faces
centrées (CFC).
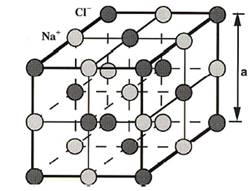
C'est un cube d'arête
a=560 pm dont :
-Les sommets sont occupés par les ions Cl-
-Les centres des 6 faces sont occupés par les ions
Cl-
-Les milieux des 12 arêtes sont occupées par les
ions Na+
-Le centre du cube est occupé par Na+.
Dans ce schéma, une maille est l’unité de base de la structure
cristalline. C’est un parallélépipède (souvent un cube) qui se répète
régulièrement dans l’espace pour former le cristal entier. Elle contient un
certain nombre d’ions sodium (Na⁺) et d’ions chlorure
(Cl⁻) partagés avec les mailles voisines. Ici, la maille contient en moyenne
4 ions Na⁺ et 4 ions Cl⁻, ce qui donne la formule statistique NaCl.
La maille permet donc
de modéliser l’arrangement régulier des ions dans un solide ionique. Dans le
cas du chlorure de sodium (NaCl), la maille est
cubique (on parle de maille cubique à faces centrées). La cohésion du cristal
est assurée par des forces électriques entre les ions sodium et chlorure.
FORMULES STATISTIQUES DE QUELQUES COMPOSES
On attribue aux
solides ioniques une formule statistique, qui est une formulé de composition
dans laquelle n’apparait pas la charge de l’ion. L’ion positif s’écrit toujours
avant l’ion négatif. Ainsi la formule du chlorure de sodium solide s’écrira NaCl, car pour un ion sodium il y a un ion chlorure.
La formule
statistique d’un solide cristallin (comme un sel ionique) indique le rapport en
nombre d’ions ou d’atomes présents dans une maille élémentaire du cristal. Elle
ne donne pas le nombre exact total d’ions dans tout le cristal (car il en
contient un très grand nombre), mais le rapport minimal entier entre les ions
ou atomes dans la maille.
Exemple :
Ecrivons la formule statistique
du sulfate d’aluminium sachant qu’il est constitué d’ions sulfate SO2-4
et d’ions aluminium Al3+.
La formule s’écrira : Alx(SO4)y
Il faut déterminer x
et y. la neutralité électrique impose que 3x=2y. on prend les plus petites
valeurs de x et y satisfaisant cette relation, soit : x=2 et y=3
d’où la formule cherchée : Al2(SO4)3
EXERCICES
EXERCICE
I:
1.Le
cristal de chlorure de sodium possède une structure cubique à faces
centrées.
Chaque
maille élémentaire contient :
-
des ions Na⁺ aux centres des arêtes et au centre de la
maille,
-
des ions Cl⁻ aux sommets et aux centres des faces.
a)
Combien y a-t-il d’ions Na⁺ par maille ?
b)
Combien y a-t-il d’ions Cl⁻ par maille ?
c)
Quelle est la formule statistique du cristal ?
2.On
considère la maille cubique du cristal de NaCl.
Les
masses molaires sont : Na = 23 g/mol, Cl = 35,5 g/mol.
La
constante d’Avogadro est NA = 6,02 × 10²³ mol⁻¹.
a)
Quelle est la masse d’un ion Na⁺ et d’un ion Cl⁻
?
b)
En déduire la masse d’une maille.
3.La
maille cubique de NaCl a une arête de a = 564 pm (1
pm = 10⁻¹² m).
Utiliser
la masse d’une maille pour calculer la masse volumique du cristal.
EXERCICE
II :
Oxyde de magnésium (MgO)
Le cristal est formé de Mg²⁺
et O²⁻.
a)
Combien faut-il d’ions Mg²⁺ pour équilibrer un ion
O²⁻ ?
b)
Quelle est la formule statistique du cristal ?
EXERCICE
III :
Fluorure de calcium (CaF₂)
Le cristal est constitué de Ca²⁺
et F⁻.
a)
Quel est le rapport ionique nécessaire pour que le cristal soit électriquement
neutre ?
b)
En déduire la formule statistique.
CORRIGES
EXERCICE I:
1.
a) Na⁺ :
- 12 arêtes × ¼ (chaque arête partagée entre 4 mailles) = 3
- 1 centre = 1
→ Total : 4 Na⁺
b) Cl⁻ :
- 8 sommets × 1/8 = 1
- 6 faces × ½ = 3
→ Total : 4 Cl⁻
c) Rapport : Na⁺/Cl⁻ = 4/4 = 1
//
Formule NaxCly, d’après
l’équation d’électroneutralité, [Na+]=[Cl-]
donc x=y
Pour x=1, y=1
→ Formule statistique : NaCl
2.
a)
- m(Na⁺) = 23 / NA ≈ 3,82 × 10⁻²³ g
-
m(Cl⁻) = 35,5 / NA ≈ 5,90 × 10⁻²³ g
Une maille contient 4 Na⁺ et 4 Cl⁻ →
m(maille) = 4 × (m(Na⁺) + m(Cl⁻))
≈ 4 × (3,82 + 5,90) × 10⁻²³ ≈ 3,89 × 10⁻²² g
3. Calcul de la masse volumique du cristal
Volume de la maille :
V = a³ = (564 × 10⁻¹² m)³ = 1,79 × 10⁻²⁸ m³
Masse de la maille : ≈ 3,89 × 10⁻²⁵ kg
ρ = m / V ≈ (3,89 ×
10⁻²⁵)
/ (1,79 × 10⁻²⁸)
≈ 2173 kg/m³
→ La masse volumique est ≈ 2,17 × 10³ kg/m³
✦ EXERCICE
II : Oxyde de magnésium (MgO)
a) 1 ion Mg²⁺
équilibre 1 ion O²⁻ →
rapport 1:1
a) 1 ion Mg²⁺
équilibre 1 ion O²⁻ →
rapport 1:1
b) Formule statistique : MgO
// Formule MgxOy,
d’après l’équation d’électroneutralité, 2[Mg2+]=2[O2-]
donc 2x=2y
Pour x=1, y=1
EXERCICE IV : Fluorure de calcium (CaF₂)
a) Ca²⁺ : +2 ; F⁻ : −1
→ 1 Ca²⁺ nécessite 2 F⁻ pour annuler la charge
b) Formule : CaF₂
// Formule CaxFy,
d’après l’équation d’électroneutralité, 2[Ca2+]=[F-]
donc 2x=y
Pour x=1, y=2