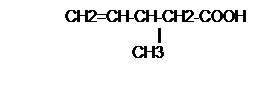LES
ACIDES CARBOXYLIQUES
DEFINITION ET NOMENCLATURE
. Les
acides carboxyliques sont des composés organiques oxygénés dont la molécule
présente le groupe fonctionnel –COOH appelé groupe carboxyle.
· Groupement carboxyle.
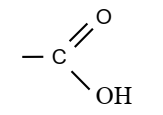
|
|
· Formule générale
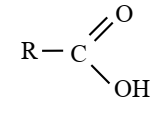
où R est :
-un atome d’hydrogène H
-un groupe alkyle : l’acide correspondant est
dit saturé.
-une chaîne avec des liaisons multiples : l’acide
correspondant est dit insaturé.
-aryle : l’acide correspondant est aromatique.
· Formule générale brute des monoacides carboxyliques saturés est : CnH2nO2.
NB : Les
composés présentant plusieurs groupes carboxyles sont des polyacides.
Nomenclature
Monoacides saturés
Le
nom d’un acide carboxylique s’obtient en faisant suivre le mot « acide
» du nom de l’hydrocarbure
correspondant à la chaîne principale où le « e » final est
remplacé par la terminaison « oïque ».
Exemples :
CH3 – CH2-COOH : acide propanoïque
CH3 –CH2 – CH2-COOH : acide butanoïque
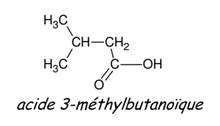
· Pour les acides à chaine ramifié, la chaîne principale
est la plus longue contenant le groupe –COOH. Elle est numérotée à partir du
carbone fonctionnel qui porte alors l’indice 1. La nature et la position des
substituants sont indiquées en respectant l’ordre alphabétique.
Exemple :
Monoacides insaturés
· Pour les dérivés d’alcènes, il faut en plus indiquer
la position de la double liaison.
|
|
Acide 2-methylbut-4-enoique
· Pour les acides aromatiques, le nom est obtenu en
ajoutant le suffixe « carboxylique » au nom de l’hydrocarbure
correspondant, précédé du mot « acide ». L’atome C directement lié au
groupe carboxyle porte l’indice 1.
 Acide benzène carboxylique
Acide benzène carboxylique
Polyacides
· Pour les diacides saturés, la chaine principale est
celle qui contient les deux carbones fonctionnels. Le sens de numérotation est
celui qui accorde les plus petits indices aux substituants. Le nom de l’acide
s’obtient en remplaçant le « e » final de l’alcane correspondant par la
terminaison « edioïque ».
Exemple
: HOOC-CH2-CH2-COOH
: Acide butanedioique
· Pour les diacides aromatiques, le nom s’obtient en
ajoutant le suffixe « dicarboxylique » au nom de l’hydrocarbure correspondant,
précédé du mot « acide ».
Exemple :
PROPRIETES CHIMIQUES
Propriétés acides
A 25![]() C, les
solutions d’acides carboxyliques ont un pH<7. En solution aqueuse, les
acides carboxyliques sont partiellement dissociés, donc les acides
carboxyliques sont des acides faibles.
C, les
solutions d’acides carboxyliques ont un pH<7. En solution aqueuse, les
acides carboxyliques sont partiellement dissociés, donc les acides
carboxyliques sont des acides faibles.
La réaction d’un acide carboxylique avec l’eau est
réversible. On obtient l’ion carboxylate R-COO-.
![]()
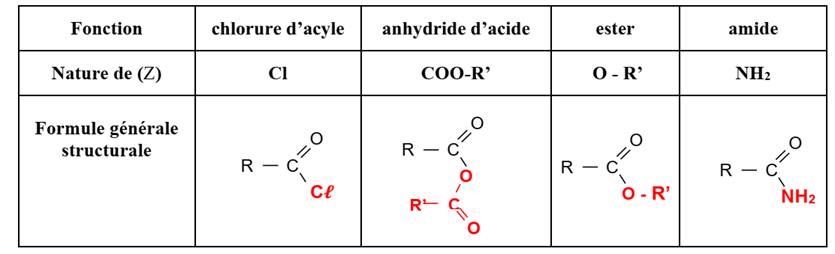
Les dérivés des acides carboxyliques
La formule générale des dérivés
des acides carboxyliques est de la forme :
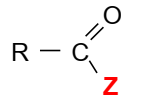
Les chlorures
d’acyle ou chlorures d’acide
a) Obtention
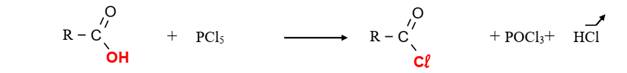
La réaction d’un acide avec un agent chlorurant tel que
le pentachlorure de phosphore ou le chlorure de thyonile
produit un chlorure d’acyle. :
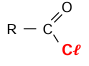
-Avec le chlorure de thionyle SOCl2:
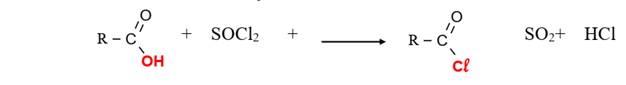
- Avec le pentachlorure de phosphore (PCl5) :
b) Nomenclature
Le nom d’un chlorure d’acyle est obtenu à partir de celui de l’acide
carboxylique correspondant en
remplaçant « acide » par « chlorure de » et la terminaison « oïque » par « oyle ».

Les chlorures d’acyles sont des composés très réactifs. Leur réaction avec
l’eau (hydrolyse) ou avec l’alcool (estérification) est rapide, totale et
exothermique.
Les anhydrides d’acide
a) Obtention
Un
anhydride d’acide résulte de l’élimination d’une molécule d’eau entre deux
molécules d’acides
carboxyliques. Cette déshydratation se fait par simple chauffage et en présence
d’un déshydratant énergétique
comme le décaoxyde de tétraphosphore (P4O10).
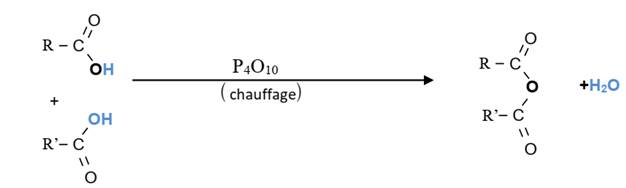
b) Nomenclature
Le nom d’un anhydride d’acide s’obtient en remplaçant dans celui de l’acide, le
mot « acide » par le mot « anhydride ».

Remarques :
·
Lorsque les deux chaines carbonées
de l’anhydride sont différentes (anhydride mixte) , le
nom dérive de ceux des deux acides correspondants.
Exemple :
CH3-CO-O-CO-CH2CH3 : anhydride éthanoïque et propanoïque.
·
Leur hydratation reforme
l’anhydride de départ
Exemple: CH3-CO-O-CO-CH3 + H2O
→ 2 CH3-CO-O-CO-CH3
·
Leur réaction avec les alcools
produit un ester et un acide carboxylique’
Exemple : CH3-CO-O-CO-CH3 + CH3CH2OH
→CH3COOC2H5 + CH3COOH.
Les amides
Un amide dérive d’un acide carboxylique par
emplacement du groupe hydroxyde -OH par un groupe aminé tel que -
NH2, -NHR’ ou -NR’R’’ :
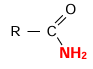
a) Obtention
Ils peuvent s’obtenir :
▪ À partir d’un acide carboxylique et de l’ammoniac
La réaction se déroule en deux étapes et on obtient un amide non substitué.
1ère étape : C’est une simple réaction acide-base qui aboutit à la
formation d’un carboxylate d’ammonium.
L’équation-bilan est :
R – COOH + NH3 ⟶ R – COO- + NH4+
2e étape :
Déshydratation du carboxylate d’ammonium par chauffage :
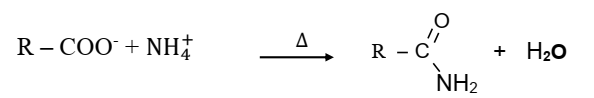
▪ A partir d’un chlorure d’acyle et de l’ammoniac
La réaction est rapide, totale et se déroule en une seule étape.
Les équations – bilans s’écrivent :
R – COCl + NH3⟶ R – CO – NH2 + HCl
·
A partir d’un
anhydride d’acide
La synthèse d’amide à partir d’un anhydride d’acide
est une réaction totale très utilisée. Mais elle est moins rapide que les
précédentes.
Exemple :
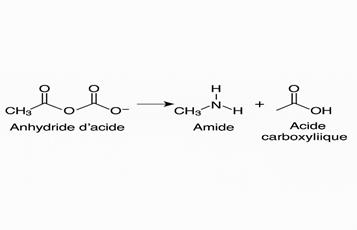
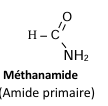
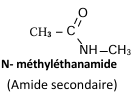
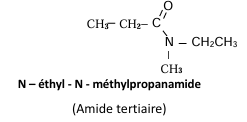
b) Nomenclature
Le nom d’un amide s’obtient en remplaçant le « e » final du nom de
l’hydrocarbure correspondant par
« amide » et précédé de la lettre N avant le nom de chaque
substituant de l’atome d’azote.
Exemples :
Remarque :
·
Le groupe fonctionnel amide est
très stable chimiquement : cette propriété permet à la molécule de
résister à l’eau et aux solutions d’acide et de base.
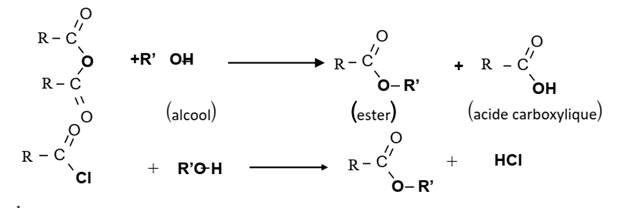
Les esters
a) Les réactions d’estérification
▪ Estérification directe
C’est la réaction entre un acide carboxylique et un alcool.
Cette réaction est lente, athermique, réversible et limitée.
Son équation bilan générale s’écrit :

La réaction inverse de l’estérification directe est appelée hydrolyse
d’un ester. Elle possède les mêmes
caractéristiques que l’estérification directe.
▪ Estérification indirecte
C’est la réaction entre un dérivé d’acide (chlorure d’acyle ou anhydride
d’acide) et un alcool. Cette réaction
est totale, rapide et exothermique.
b) Nomenclature
Le nom d’un ester s’obtient à partir de celui de l’acide carboxylique
correspondant, en :
- supprimant le mot ‘’acide’’
- remplaçant le suffixe ‘’oïque’’ par ‘’oate’’,
- ajoutant la préposition « de » ou « d’ » suivi du
nom du groupe alkyle lié à l’atome d’oxygène.
Exemple :

c)Rendement

Tableau récapitulatif
EXERCICES
EXERCICE I :
La composition massique d’un monoacide carboxylique à
chaîne saturée comprend 58,8% de carbone et 9,8% d’hydrogène.
1. Donner sa formule brute.
2. La formule brute d’un acide carboxylique A
s’écrit : C4H8O2
Déterminer le composé A, sachant qu’il présente une
chaine ramifiée.
EXERCICE II :
On considère un acide carboxylique A à chaîne saturée.
1, Soit n le nombre d’atomes de carbone du radical R
lié au groupe carbonyle. Ecrire la formule générale de A en fonction de n.
2. Un alcool B a pour formule brute CH4O.
Ecrire la formule semi-développée de B et donner son nom.
3.On estérifie l’acide A par l’alcool B.
Ecrire l’équation de la réaction.
Déterminer la formule réelle et le nom de l’acide A,
sachant que la masse molaire de l’ester obtenu est de 88 g.mol-1.
4. On note C le chlorure d’acyle dérivé de l’acide A
Ecrire la formule semi-développée de C.
Expliquer comment obtenir cette formule à partir de
celle de A.
Quelles sont les différences importantes qui existent
entre l’action de A sur B, et de celle de C sur B ?
EXERCICE III :
On chauffe un mélange compose de 6 g d’acide
éthanoïque et de 6 g d’éthanol. Il se forme de l’eau et un compose B de masse
molaire 102 g/mol. Au bout d’un certain temps, on constate que la masse d’acide
éthanoïque reste constante. La masse de de A est alors 6,12 g.
1-Ecre l’équation de la réaction en précisant le
compose B.
2-De quelle réaction s’agit-il ?
3-Calculer le rendement de cette réaction.
EXERCICE IV :
La vapeur d’un composé A a
pour densité par rapport à l’air d=2,07. Ce composé est constitué de 60% de
carbone, 13,3% d’hydrogène et 26, 7% d’oxygène.
1. Trouver la formule de A
2. On réalise un mélange de A et d’acide propanoïque auquel on ajoute deux gouttes d’acide sulfurique.
La masse du mélange obtenu est de 20g. Il est placé dans une enceinte où règne
une température constante de 20°C.
2.1.
Ecrire l’équation bilan de la réaction qui a lieu.
Quel
est le rôle de l’acide sulfurique ?
Nommer
le composé organique obtenu
2.2.
Calculer le nombre initial de moles de chaque réactif, sachant qu’à la limite,
on a obtenu 10,2 g d’ester et que le rendement de la réaction est de 60%.
EXERCICE V :
Au
cours d’une séance de travaux pratiques, ton groupe de travail désire
déterminer la formule semi-développée d’un composé D, puis de l’utiliser sous
la supervision de leur professeur de physique –chimie pour obtenir les dérivés
d’acides carboxyliques. Pour cela, le groupe réalise une série d’expérience :
Expérience
1 : L’oxydation ménagée d’un alcool primaire A de formule R−CH2OH
et non ramifiée, donne un composé organique B, qui rosit le réactif de Schiff
et B à son tour est transformé en un produit D, qui jaunit le bleu de
bromothymol.
Expérience
2 : Il dissout 0,37 g de D dans un litre d’eau ; on prélève Va = 50 mL de cette solution que l’on dose avec une solution
d’hydroxyde de sodium de concentration molaire volumique Cb = 10-2 mol.L - 1.
L’équivalence
acido-basique a lieu quand on a ajouté Vb = 25 mL.
Expérience
3 : On fait agir du pentachlorure de phosphore PCℓ5 sur le composé D, et
on obtient un composé organique E. Le composé E réagit avec l’ammoniac pour
donner un composé organique F
Tu
es choisi par le groupe pour faire la rédaction du compte rendu
Données
en g/mol : MC = 12 ; MH = 1 ; MO = 16
1.
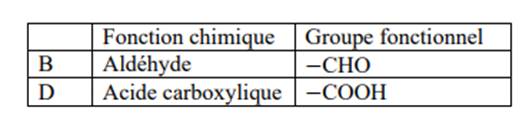
Donne la fonction chimique et le groupe fonctionnel de B et D
2.
2.1. Écris l’équation-bilan de la réaction acido-basique ;
2.2.
Détermine la formule brute du composé D ;
2.3.
Donne le nom et la formule semi-développée du composé D ;
2.4.
Déduis de ces expériences la formule semi-développée et le nom de A.
3.
3.1.Écris l’équation-bilan de la réaction :
3.1.1.
Du composé D au composé E ;
3.1.2.
Du composé E sur l’ammoniac ;
3.2.
Nomme le composé F et précise sa famille chimique
CORRIGES :
EXERCICE I :
1. formule brute générale : CnH2nO2.
%O=(2X16/M) x100 =>M=3200/%O=3200/(100-(58,8+9)=101,91g/mol
M=14n +32=101,91 <= >14n=69,91 => n=5
Formule brute: C5H10O2
2.Acide 2-methylpropanoique
.CH3-CH(CH3)-COOH
EXERCICE II :
1, CnH2n+1-COOH
2. CH3-OH : methanol
3.Équation de la réaction. CH3-OH+ CnH2n+1-COOH ⇌ CnH2n+1-COOCH3 +H2O
M=14n+60 = 88 => n=2
Formule réelle :C2H5-COOH (Acide propanoïque).
4. On note C le chlorure d’acyle dérivé de l’acide A
Formule semi-développée de C : C2H5-COCl
On fait agir l’acide avec du chlorure de thionyle
(SOCl2)
C2H5-COOH + SOCl2 →
C2H5-COCl +SO2+HCl
-réaction de C sur B Plus rapide, totale et exothermique.
EXERCICE III:
1-C2H5OH+ CH3-COOH ⇌ ![]() CH3-COO(C2H5) +
H2O
CH3-COO(C2H5) +
H2O
Compose B: Ethanoate d’ethyl
2-esteriication
3- Macid=2x12+4+2x16=60
g/mol, Mest=102 g/mol

EXERCICE IV :
1. Formule
de A : CxHyOz
M=29d=29x2,07=60,03g
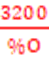

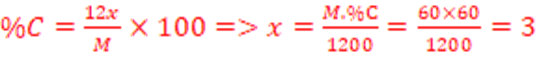
=>C3H8O
2-
2.1.
Equation bilan de la réaction :
C3H7OH+ C2H5-COOH ⇌ ![]() C2H5-COO(C3H7)
+ H2O
C2H5-COO(C3H7)
+ H2O
Rôle de
l’acide sulfurique : Catalyseur
Nom
du composé organique obtenu :
Propanoate de propyl
2.2. ![]() =>
=> ![]()
![]()
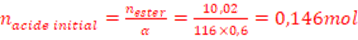
EXERCICE V :
1. Fonction chimique et groupe fonctionnel de B et D
2. 2.1. Équation –bilan de la réaction acido-basique :
![]()
2.2. A l'équivalence acido-basique CaVa = CbVBe, la valeur de Ca =
5.10-3mol.L-1
![]()
On
pose alors 14n +32 = 74 d’où n = 3
La
formule brute est : C3H6O2
2.3. Nom et formule semi-développée de D :
2.4. CH3CH2COOH : acide propanoïque
3.1.
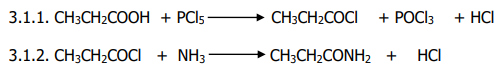
3.3.
Nom : Propanamide, fonction chimique : Amide
Merci de votre visite
Laissez un commentaire