LES ALCOOLS
DEFINITION
ET NOMENCLATURE
Définition
. On appelle alcool un composé
organique possédant un groupe hydroxyle (–OH) lié à un atome de carbone tétragonal.
Tous les alcools possèdent un groupe d’atome appelé groupe fonctionnel de
formule C–OH. Le carbone qui porte le groupe hydroxyle est appelé carbone fonctionnel. Il est tétragonal
car il est lié quatre atomes voisins par des liaisons covalentes simples.
·
Formule
générale des alcools est : R–OH avec R groupement alkyle de formule CnH2n+1.
·
Formule brute est : CnH2n+2 O avec (n≥ 1).
Nomenclature
. Le nom d’un
alcool dérive du nom de l’hydrocarbure qui lui a donné naissance : il est
obtenu en remplaçant le « e »
final par
le suffixe « ol ».
-La
chaine carbonée la plus longue (chaine principale) est celle qui passe par le
carbone fonctionnel.
-le
sens de numérotation des atomes de carbone de la chaine est celui qui permet
d’affecter le numéro le plus bas possible au carbone fonctionnel.
-La
position du groupe -OH est indiquée par un tiret, suivi du numéro du carbone
fonctionnel.
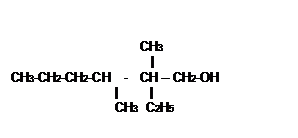
-Les substituants sont cités dans l’ordre
alphabétique, les préfixes multiplicatifs di, tri…ne sont pas pris en compte.
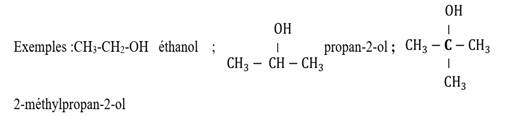
Exemple :
2-ethyl,2-3dimethylhexan-1-ol
LES
3 CLASSES D’ALCOOL
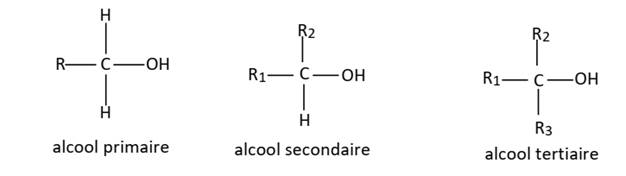
. Les alcools, regroupés en
trois classes, se distinguent par le nombre d’atomes de auxquels ils sont
directement liés. Ainsi, lorsque le carbone fonctionnel est lié à:
-0 ou1atome de carbone, l’alcool est primaire.
-2 atomes de carbone, l’alcool est secondaire.
-3 atomes de carbone, l’alcool est tertiaire.
PROPRIETES
CHIMIQUES DES ALCOOLS
Réaction
avec le sodium
. L’alcool réagit avec le sodium
pour donner un alcoolate de sodium.

Déshydratation
d’un alcool
- La déshydratation intramoléculaire conduit à un alcène. Elle se
fait en milieu acide (sulfurique).
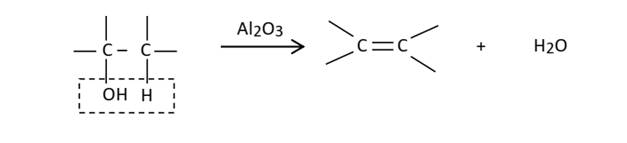
Al2O3 : alumine
- La déshydratation intermoléculaire conduit à un étheroxyde
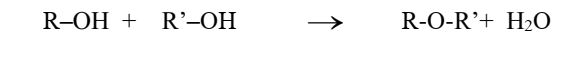
Combustion
des alcools
-Elle produit du dioxyde de carbone et de
l’eau. Elle s’accompagne d’une destruction de la chaine carbonée.
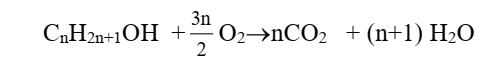
Oxydation
ménagée des alcools
L’oxydation ménagée
s’effectue sans destruction de la chaîne carbonée.
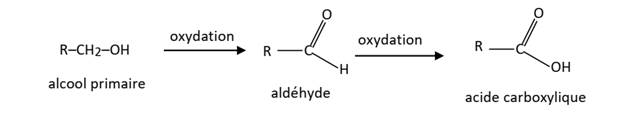
Cas des alcools
primaires
. Un alcool primaire
s’oxyde pour donner un aldéhyde si l’oxydant est en défaut ou un acide
carboxylique si l’oxydant est en excès.
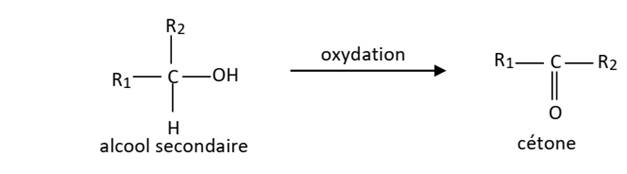
Cas des alcools
secondaires
Ils sont oxydables en cétone.
Cas des alcools tertiaires
Les alcools tertiaires ne sont pas oxydables.
Oxydation
en solution aqueuse
- Avec un alcool primaire
L’oxydation de l’éthanol en milieu acide par le dichromate de potassium
donne l’éthanal. C’est une réaction d’oxydoréduction en milieu acide.
Equation bilan de la réaction est :
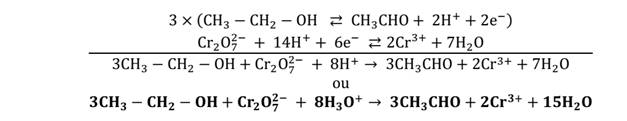
Réaction de l’oxydation de l’éthanol par une solution de dichromate
de potassium en excès. On obtient un acide carboxylique.
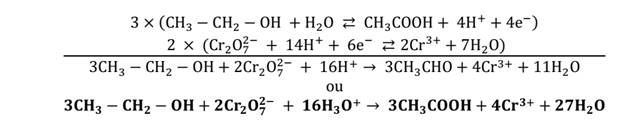
- Avec un alcool
secondaire
La réaction de l’oxydation
de l’éthanol par une solution de dichromate
de potassium en excès donne une cétone.
L’oxydation du propan-2-ol en milieu acide donne la propanone.

-L’oxydation
ménagée d’un alcool tertiaire est impossible.
Estérification
L’estérification
est l’action d’un acide carboxylique sur un alcool. Elle conduit à la formation
d’un ester et de l’eau, suivant l’équation-bilan :

L’expérience
montre que cette réaction est lente et athermique. Elle est limitée par la
réaction inverse appelée hydrolyse de l’ester qui se produit dans les
mêmes conditions. On aboutit à un équilibre chimique qui se traduit par une
double flèche. Le mélange réactionnel contient alors les quatre composes :
acide, alcool, ester et eau, dans des proportions bien définies, variables avec
la classe d’alcool.
Par élévation de température ou
l’utilisation d’un catalyseur (exemple :H2SO4), on
peut rendre l’estérification plus rapide, sans modifier l’équilibre chimique.
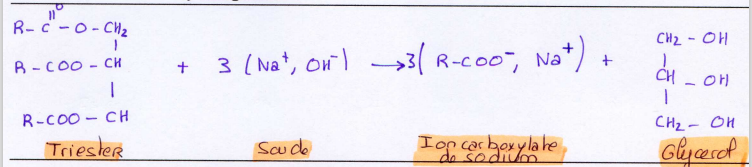
Saponification
Réaction
de saponification
La réaction des esters sur les bases fortes telle que
la soude ou la potasse conduit à un carboxylate de sodium ou de
potassium suivant la réaction d’équation bilan générale :

Corps
gras
Les corps gras sont des triesters provenant de la
réaction d’un acide gras (acide carboxylique) avec le glycérol. On les appelle aussi
des triglycérides (formes par une réaction d’estérification).
Les triglycérides sont des triesters, molécules
possédant 3 fonctions ester (formule ci-dessous). Ils sont présents dans tous
les corps gras (huile, graisses animales ou végétales).
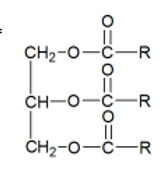
Saponification
des triglycérides par la soude
L’équation-bilan de saponification des triglycérides
par la soude s’écrit donc :
METHODE DE PREPARATION DES ALCOOLS
Par
fermentation des jus sucrés
. La fermentation du glucose
(C6H12O6) en présence d’enzymes donne
l’éthanol.
C6H12O6⟶ C2H5OH + CO2
Un sucre fermentescible est un sucre qui peut fermenter sous l'action
des levures, et donc de produire de l’alcool.
Exemple : Le glucose, le saccharose et le fructose
sont des sucres fermentescibles.
Un sucre non fermentescible est un sucre non susceptible de fermenter
sous l’action des levures.
Exemples : le lactose dans le lait, l’amidon, le sorbitol…
Par hydratation des
alcènes
L’hydratation d’un alcène
conduit à un alcool.
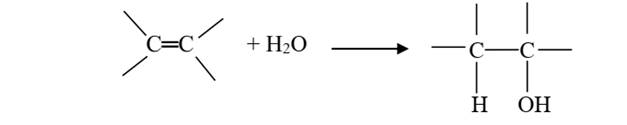
L’hydrogène se fixe sur le carbone le plus hydrogéné. C’est la règle de
Markovnikov.
LES POLYOLS
Définition
Les polyols (ou polyalcools)
sont des alcools présentant plusieurs groupes d’hydroxyles dans leurs
structures.
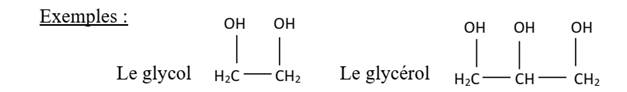
Nomenclature
On utilise les terminaison diol,
triol,…
Glycol ou
ethane-1,2-diol
Glycérol ou
propane-1,2,3-triol
Synthèse :
Le glycol se prépare en deux
étapes :
- 1ère étape : oxydation de l’éthylène par le dioxygène de l’air. On obtient
l’oxyde d’éthylène.
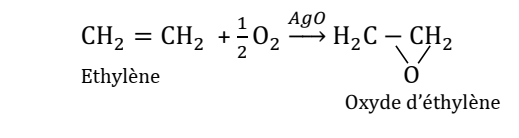
- 2ème étape : hydratation de l’oxyde d’éthylène pour obtenir le glycol.
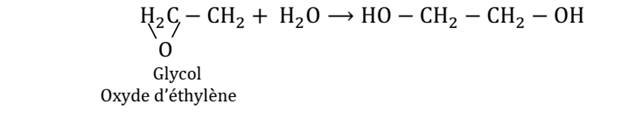
Utilisation des
polyols :
-fabrication des mousses
-additifs alimentaires
EXERCICES
EXERCICE I :
On
effectue l’oxydation de deux alcools isomères de formule brute : C3H8O.
1.
Donner le nom, la formule semi-développée et la classe de chacun des deux
isomères.
2.
Donner la nature, le nom et la formule semi-développée des produits chimiques
formés lors de l’oxydation ménagée de ces deux alcools.
EXERCICE II :
Un
composé A de masse molaire M =88g.mol-1 a la composition en masse
suivante : 68,20% de carbone ,13,65% d’hydrogène et 18,15% d’oxygène.
1.
En déduire la formule brute.
2.
Le composé A est un alcool primaire comportant un carbone trisubstitué.
Quelle
est la formule semi-développée de cet alcool ainsi que son nom ?
EXERCICE III :
On
réalise la combustion complète de 6 g d’un alcool à identifier. On obtient 7,2
g d’eau et 13,2g d’un gaz absorbable par la potasse.
1.
Déterminer la composition massique de cet alcool.
2.
En déduire la masse molaire.
3.
Quelle est sa formule brute ?
4.
Sachant qu’il est obtenu majoritairement par hydratation de l’alcène
correspondant, identifier l’alcool étudié.
EXERCICE IV :
Le
fonctionnement de l’alcootest est basé sur le changement de couleur observé lors
de l’oxydation de l’éthanol en acide éthanoïque par le dichromate de potassium
en milieu acide.
1-Quels
sont les deux couples redox mis en jeu ?
2-En
déduire l’équation-bilan de la réaction intervenant dans l’alcootest.
3-Sur
un individu en état d’ivresse, on fait un prélèvement de 10 ml de son sang
auquel on ajoute, en milieu acide, une solution de dichromate de potassium en
excès, de 20 cm3 contenant 14,7 g de dichromate de potassium par
litre. Apres un temps suffisamment long, on dose la solution obtenue et on
trouve que la concentration molaire du dichromate de potassium est de 0,024
mol.l-1.
Calculer
la concentration en grammes par litre de l’éthanol présent dans le sang de
l’individu au moment du prélèvement.
EXERCICE
V :
A.
L’huile d’olive contient principalement de l’oléine, qui est le triester du
glycérol et de l’acide oléique.
1-Ecrire
la formule semi-développée du glycérol (propene-1,2,3-triol).
2-Determiner
les formules brute et semi-développée de l’oléine.
B.
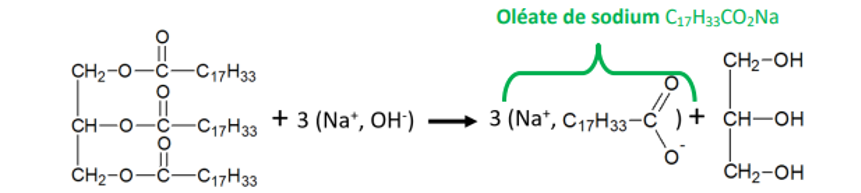
On fait réagir une tonne d’oléine avec la soude en excès’
1-Comment
appelle-t-on la réaction entre un triester et la soude ? Ecrire son
équation bilan et nommer les produits de cette réaction.
2-Determiner
la masse de savon obtenue sachant que la réaction est totale.
Données :
Masses
molaires : de l’oléine :884g/mol ; de l’oléate de sodium :304
g/mol ; de la soude :40 g/mol.
CORRIGES
EXERCICE I :
1. Nom, la formule semi-développée et la classe de chacun des deux
isomères.
|
Nom |
Formule |
Classe |
|
Propan-1-ol |
CH3-CH2-CH2-OH |
I |
|
Propan-2-ol |
CH3-CHOH-CH3 |
II |
2. Nature, le nom et la formule semi-développée des produits
chimiques formés
Lors de l’oxydation ménagée de ces deux alcools.
|
|
Nature |
Nom |
Formule |
|
I |
Aldéhyde |
Ethanal |
CH3-CH2-CHO |
|
II |
Cétone |
Ethanone |
CH3-CO-CH3 |
EXERCICE II :
1. formule brute :
CxHyOz
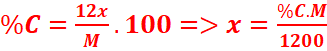 =
=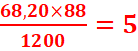
%H=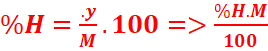 =
=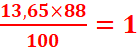
%O=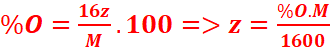 =
=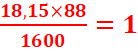
Formule brute : C5H12O
2.
C2H5-CH(CH3)-CH2OH:
2-methylbutan-1-ol
EXERCICE III
:
1. Composition massique de
cet alcool.
mC=![]() x12=3,6g
x12=3,6g
%C=(mc/m)x100=3,6/6 x100=60
mH=7,2/18
x2=0,8g
%H=(mH/m)
x100=![]() x100=13,33
x100=13,33
%O=100-(60+13,33)=26,67
2. Masse molaire.
%O=(16/100) x100 =>
M=1600/%O=1600/26,67=60g.mol-1.
3. formule brute
CnH2n+2 O
M=mC+mH+mO=12n+2n+2+16=14n+18=60
=>n=(60-18)/14=3
La formule brute est : C3H8O
4. Propan-2-ol
EXERCICE IV :
1- Cr2O-7/CH3CH2OH
2-3CH3CH2OH + 2Cr2O-7
+16H3O+ →3CH3COOH +4Cr2+ +27H2O
3-Nombre de moles apporté par le dichromate de potassium après
dilution avec le sang :
M(K2Cr2O7)=2x39+2x52+7x16=294
g.mol-1
[Cr2O-7]initial
=14,7 g/l =14,7/294=0,05 mol/l soit n(Cr2O-7)initial=0,05x0,020=0,001
mol
[Cr2O-7]final=0,024
mol/l soit n(Cr2O-7)final=0,024x0,030=0,00072
mol
Le nombre de mole de dichromate ayant réagi est :
nr= n(Cr2O-7)initial - n(Cr2O-7)final=0.001-0.00072=0,00028
mol.
Le nombre de moles d’alcool ayant réagi est :
n(alc)/3=n(Cr2O-7)/2
=> n(alc)=1,5x0,00028=0,00042 moles //d’après l’équation-bilan
Tout l’alcool présent dans le sang initial a totalement réagi ;
[alc]=0,0042x46/0,01=1,93g/l
EXERCICE V :
A.
1-Formule semi-développée du glycérol (propane-1,2,3-triol).
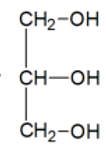
2-
Formule brute :
(C17H33COO)3C3H5
Formule semi-développée :
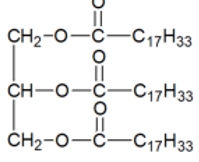
B.
1-.
Saponification
2-Masse de savon obtenue.
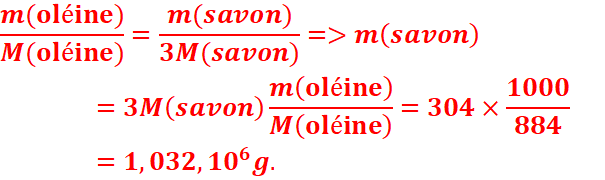
Merci de votre visite
Laissez un commentaire