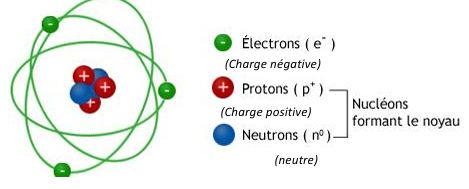
LE NOYAU ATOMIQUE
Le noyau est constitué des protons
et des neutrons. On les appelle des nucléons.
Le proton est chargé d’électricité positive.
Charge du proton : qp=e=1,6.10-19C
Masse du proton : mp=1,67.10-27kg
Le neutron est électriquement neutre, il ne porte pas de charge
électrique.
Charge du neutron : qn=0
Masse du neutron : mn=1,67.10-27kg
Les protons sont les seuls
responsables de la charge positive du noyau.
EXPERIENCE DE RUTHERFORD
L'expérience de la
feuille d'or de Rutherford
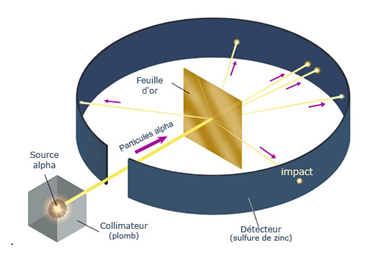
Matériel utilisé :
- Source radioactive : Un morceau de radium (ou d'américium pour
les versions modernes) est placé dans une boîte de plomb percée d'un petit
orifice, créant un faisceau étroit de particules alpha.
- Cible : Une fine feuille d'or, choisie pour sa grande
malléabilité qui permettait de la réduire à une épaisseur de quelques
atomes.
- Détecteur : Un écran fluorescent en sulfure de zinc, placé autour
de la feuille d'or, qui produit de minuscules éclairs de lumière
(scintillations) lorsqu'il est frappé par une particule alpha.
Observations et résultats :
- La plupart des particules alpha (99,9 %) traversent la feuille
d'or sans être déviées ou avec une déviation minime.
- Quelques particules sont déviées à des angles importants.
- Un très petit nombre de particules (environ 1 sur 8 000) rebondit
carrément en arrière, comme si elles avaient heurté un obstacle
dense. Rutherford a comparé ce résultat à celui d'un boulet de canon qui
aurait rebondi sur une feuille de papier.
Conclusions de Rutherford :
- L'atome est principalement composé de vide. Comme la grande
majorité des particules alpha traverse la feuille d'or sans obstacle, la
matière est une structure lacunaire, faite en grande partie de vide.
- La charge positive et la masse de l'atome sont concentrées dans un
petit noyau. Pour expliquer les déviations importantes et les rebonds,
il a fallu postuler l'existence d'un noyau central, dense et chargé
positivement, capable de repousser fortement les particules alpha, elles
aussi positives.
- Les électrons se trouvent en orbite autour du noyau, à grande
distance. C'est le modèle planétaire de l'atome
LE MODELE ATOMIQUE DE RUTHERFORD
•
L’atome est composé en majeure partie de vide
• La masse de l’atome est concentrée
dans le noyau
• Les particules de charge positive
sont appelées protons et composent le noyau
• Les
électrons de masse négligeable et orbitent autour du noyau un peu comme des
planètes autour du soleil
• Leur charge électrique est égale à
celle des protons, mais de signe contraire (négatif), ce qui fait que l’atome
est globalement neutre
REPRESENTATION SYMBOLIQUE D’UN NOYAU
ATOMIQUE
L’élément est représenté :
A
: nombre de masse, il désigne le nombre de proton plus le
nombre de neutrons.
Z
: numéro atomique ou nombre de charge, désigne le nombre de
proton.
N
: nombre de neutron.
Donc,
pour un élément de numéro atomique Z et de nombre de masse A, nous aurons :
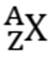
Remarque :
· Dans un atome, le nombre d’électrons est égal au nombre de protons Z.
·
Si l’élément est ionisé (chargé), le nombre d’électron est
différent du nombre de protons.
Exemple ;
l’atome de sodium Na possède 11 protons et 11 électrons
L’ion sodium Na+
possède 11 protons et 10 électrons
ISOTOPES
Les atomes qui ont le même
numéro atomique Z, mais de nombre de masse A différents, sont des isotopes de l’élément de numéro
atomique Z.
Exemple :
![]() et
et
![]() sont les isotopes de l’uranium
sont les isotopes de l’uranium
On appelle nucléide,
l’ensemble des atomes dont le noyau possède le même nombre de charge et le même
nombre de masse. Des nucléides isotopes appartiennent au même élément chimique.
EXERCICES
EXERCICE I:
1. L’atome d’oxygène possède 3 isotopes :![]() ;
;![]()
![]()
Déterminer, pour chaque isotope, le nombre de charge
Z, le nombre de masse A et le nombre de neutrons N.
2. L’uranium présente dans la nature deux
isotopes : Uranium 235 et Uranium 238. Son noyau possède 92 protons.
21. Quel est le nombre de neutrons dans chaque
isotope ?
22.Donner les représentations du noyau de l’atome
d’uranium.
EXERCICE II:
On considère un atome de carbone dont le noyau est
représenté par ![]()
1. Déterminer la
composition du noyau de cet atome
2. Combien
d’électrons possède-il ?
Ecrire sa formule
électronique et sa représentation de Lewis
3. En utilisant
la masse des particules donnée dans le cours, calculer :
-la masse du
noyau
-la masse de
l’atome
EXERCICE III :
1. L’atome de sodium
possède 11 électrons. Ecrire sa configuration électronique
2. L’atome d’hélium a
pour notation symbolique![]() . Ecrire sa
configuration électronique
. Ecrire sa
configuration électronique
3. L’atome d’Argon appartient
à la 18ème colonne de la 3ème période. Ecrire sa configuration électronique
4. Le chlorure de sodium
est composé des ions Cl- et Na+. Donner la configuration électronique de ces
deux ions.
Données : ![]()
SOLUTIONS
EXERCICE I:
1.Pour ![]() Z=8 et A=16
Z=8 et A=16
A=Z+N => N=A-Z=16-8=8 neutrons
Pour ![]() Z=8 et A=17
Z=8 et A=17
A=Z+N => N=A-Z=17-8=9 neutrons
Pour ![]() Z=8 et A=18
Z=8 et A=18
A=Z+N => N=A-Z=18-8=10 neutrons
21.
142 et 146
22.![]() et
et ![]()
EXERCICE II:
1.
A=12, Z=6 et N=A-Z=12-6=6
2. Z=6
électrons . . //pour
les atomes, le nombre de protons est égal au nombre d’électrons
Formule
électronique : K2L4
et sa représentation
de Lewis :

3.
-la
masse du noyau : mnoyau=6mp+6mn=6(1,67.10-27 +1,67.10-27)
=20,04. 10-27 kg
-la
masse de l’atome : matome=mnoyau +mélectrons=20,04.10-27
+ 6.9,1.10-31=20,04.10-27+54,1.10-31=20,04.10-27
+0,0054.10-27=20,04054.10-27 kg
//elle est pratiquement égale à celle de
son noyau 20,04. 10-27 kg.
EXERCICE
III:
1. Configuration électronique
du sodium (Z=11) : K2L8M1
2. Configuration électronique de![]() (Z=2) : K2
(Z=2) : K2
3. Configuration électronique l’argon (Z=18) :K2L8M8
4. Configuration électronique
de Na+ : K2L8
Configuration électronique de Cl- :
K2L8M7
Avez-vous
un exercice à proposer ? Cliquez-ici
Merci de votre visite
Laissez
un commentaire