LES COMPOSES AROMATIQUES
La molécule de benzène.
Le benzène, de formule C6H6,
est liquide à la température ordinaire. C’est le composé le plus connu de la
famille des composés aromatiques. A l’origine le terme aromatique désignait une
famille de substances possédant une odeur caractéristique, souvent agréable.
·
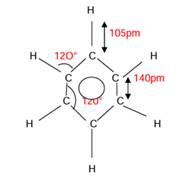
La molécule est plane : les centres des 6
atomes de carbone et des 6 atomes d’hydrogène sont dans le même plan. Les 6
atomes de carbone sont situés aux sommets d’un hexagone régulier. Les liaisons
carbone-carbone ont toutes la même longueur :140 pm. Les longueurs des
liaisons carbone-hydrogène vaut 110 pm. Les angles entre deux liaisons voisines
valent 120![]() ,
,
·
Chaque atome de carbone lié à deux atomes de
carbone et à un atome d’hydrogène, engage 3 électrons dans des liaisons de
covalence simple. Il reste donc pour l’ensemble de la molécule ,6
électrons célibataires non engagés dans des liaisons. Les 6 électrons se
déplacent autour des 6 atomes de carbone, sans être situés autour de deux
atomes donnés. On dit qu’ils sont délocalisés. Les électrons forment un
nuage électronique qui s’étend sur l’ensemble de la chaine carbonée. Un
ensemble de 6 atomes de carbones liés comme dans le benzène, par des liaisons
simples et une liaison délocalisée, est appelé noyau benzénique ou noyau
aromatique.
On représente schématiquement la molécule de benzène par la
formule :
|
|
Ou
par convention : |
Exemples de composés aromatiques
On appelle composé
aromatique tout composé organique comportant au moins un noyau benzénique.
Le toluène ou méthyl benzène(C6H5-CH3), Le
phénol (C6H5-OH), l’aniline ou aminobenzene
(C6H5-NH2), le styrène ou phenylethylene
(C6H5-CH=CH2),le
naphtalène (C10H8) et le diphényle (C12H10)
sont des exemples de composés aromatiques.

Propriétés Physiques
Masse
molaire :
78,12 g.mol-1
Température d’ébullition
:
80,1°C
Température de fusion
:
5,5°C
Densité
:
0,8765 20/4
Indice de réfraction : 1,5011 20
Solubilité
:
éthanol, acétone, éther, acide acétique
Risque
:
Facilement inflammable et Toxique
Propriétés chimiques
La combustion, réaction de destruction
Dans le dioxygène le benzène brule dans le dioxygène pour
donner le dioxyde et de l’eau.
2C6H6 + 15O2→12CO2+6H2O
Cette réaction est exothermique. Ce fort dégagement de chaleur pourrait faire
du benzène un excellent combustible, on ne l'utilise pas à cause de sa
toxicité.
Les réactions d’addition
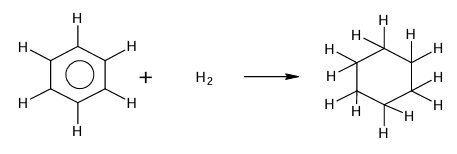
Hydrogénation
En faisant passer un courant gazeux riche en hydrogène dans
du benzène contenant un catalyseur d’hydrogénation, chaque molécule de benzène
fixe trois molécules d’hydrogène. On obtient ainsi le cyclohexane.
Catalyseur :
Pt ou Ni
C6H6
+ 3H2→C6H12
ou
Remarques :
-Dans les conditions normales de températures et de
pressions, le mélange de dihydrogène et de benzène ne réagit pas. Il faut une
température de 200°C et sous une pression de 40 bars.
-Les six atomes de carbone du cycle ne se trouvent plus
dans le même plan. En effet, cette réaction s’accompagne d’un profond
changement de structure de la molécule qui reste hexagonale, mais n’est plus
plane. Le cyclohexane peut présenter de multiples conformations :

Addition du dichlore
Dans un flacon contenant du
dichlore, versons quelques gouttes de benzène. La réaction n’a lieu que lorsque
nous exposons le mélange à la lumière : on observe aussitôt une fumée blanche
remplissant le flacon et au bout de quelques instants des cristaux blancs se
déposent sur les parois du flacon : il s’agit du 1, 2, 3, 4, 5,
6-hexachlorocyclohexane.
C6H6
+ Cl2 → C6H6Cl
ou

Cette
réaction a lieu sous l'action des ultra-violets, à la température ordinaire ;
le benzène se sature en une seule fois, on obtient le 1,2,3,4,5,6-hexachlorocyclohexane
(anciennement utilisé comme insecticide sous l'appellation commerciale HCH).
Remarque
: les six
atomes de carbone du cycle ne se trouve plus dans un même plan.
Conclusion : Ces réactions
d'addition sont beaucoup plus difficiles à réaliser qu'avec les alcènes et les
alcynes. Le benzène n’additionne ni l’eau, ni le chlorure d’hydrogène. Il ne
donne pas non plus des réactions de polymérisation.
Les
réactions d’addition se font en une seule étape et conduisent à la formation de
molécules cycliques saturées, non planes. Au cours de ces réactions le noyau
benzénique n’est pas conservé.
Une réaction de substitution
sur le benzène consiste à remplacer un atome d’hydrogène par un atome ou un
groupe d’atome, tout en conservant le noyau benzénique. Les réactions de
substitution sont faciles et variées : nitration, sulfonation, halogénation… . Toutes conservent la structure très stable du noyau
benzénique.
La bromation
Il se forme essentiellement du bromobenzene,
résultat de la substitution d’un atome de brome a un atome d’hydrogène.
C6H6+Br2
→C6H5Br + HBr
La substitution conserve le noyau benzénique.
Chloration
En présence d’un
catalyseur, le chlorure d’aluminium, AlCl3, le dichlore réagit avec
le benzène pour donner
le chlorobenzène, d’après la réaction de
substitution suivante :
C6H6
+ Cl2 →C6H5Cl + HCl
ou

·
Lorsque
le dichlore n’est pas en excès, on obtient une monosubstitution.
·
Lorsque
le dichlore est en excès et que la réaction se poursuit, on obtient une di,
tri, tétra, penta puis une hexasubstitution.
·
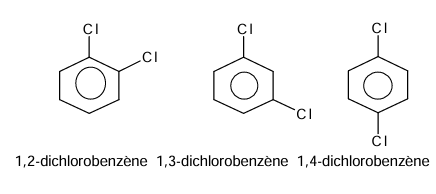
La
réaction de disubstitution fournit un mélange de
trois isomères.
Remarque : Afin
d’éviter une réaction d’addition, on opère à l’abri de la lumière
Nitration
L’acide nitrique (HNO3 )
concentré réagit sur le benzène avec pour catalyseur l’acide sulfurique (H2SO4)
concentré. On obtient
le nitrobenzene.
C6H6 +HNO3 →C6H5-NO2
+H2O
ou

Remarque
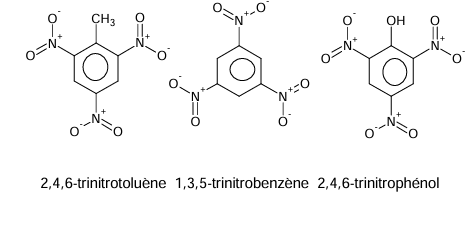
Les dérivés polynitrés (dont la molécule comporte plusieurs groupes
nitro) sont des explosifs ; c’est le cas des produits suivants :
2,4,6-trinitrotoluène 1,3,5-trinitrobenzène 2,4,6-trinitrophénol
Remarque :
Les régioisomères sont des isomères de constitution qui
diffèrent par la position d’un groupe fonctionnel ou d’un substituant sur une
même chaîne carbonée ou un même cycle.

Exemple : Lors de la nitration
du benzène disubstitué, comme le toluène (C₆H₅CH₃),
on peut obtenir trois produits différents selon la position du groupement NO₂
:
-
Ortho- (adjacent au CH₃)
-
Méta- (à une position d'écart)
-
Para- (en face du CH₃)
Sulfonation
L’action de l’acide sulfurique concentré sur le benzène
conduit à la formation de l’acide benzenesulfonique
selon l’équation bilan de la réaction suivante :
C6H6 + H2SO4 →C6H5-SO3H + H2O
ou
Pour obtenir un bon rendement, on utilise un oléum, mélange
d’acide sulfurique concentré et du dioxyde de soufre. Comme pour la nitration,
on peut obtenir des dérivés di- et trisulfonés en
position 3 et 5 respectivement.
Réaction de Friedel et Crafts (alkylation)
Il y a alkylation lorsqu’un
groupe alkyle(R-X) se substitue à un atome d’hydrogène en présence d’un
catalyseur, le chlorure d’aluminium
C6H6
+ CH3Cl
→ C6H5-CH3 +HCl
On obtient le méthylbenzène
ou toluène
D’une façon générale,

Conclusion : le benzène donne
d’importants réactions de substitution au cours desquelles le noyau benzénique
est conservé.
EXERCICES
EXERCICE
I :
1.Ecrire
les formules semi-développées des hydrocarbures dont les noms suivent :
a)
1, 3, 5-trinitrobenzène
b) Orthodipropylbenzène
c)
1, 3, 5-trichlorobenzène
d)
2, 4, 6-trichlorotoluène
2.
a) Ecrire tous les isomères aromatiques du diméthylbenzène. Donner leurs noms en nomenclature
officielle.
b) En déduire les isomères de tétraméthylbenzène, et les nommer.
3.
Trouver les formules semi-développées des composés ayant pour formules brutes C8H10.
EXERCICE VII :
Un
corps A de masse molaire 78g/mol renferme en masse 92.3% de carbone et 7.7%
d’hydrogène.
1)
Trouver la formule brute du composé.
2)
Ce composé réagit avec le dihydrogène et donne du cyclohexane.
a)
Nommer le corps A et donner sa formule développée.
b)
Ecrire l’équation de la réaction. Quel est le nom de la réaction correspondant
?
3)
Quel volume de dihydrogène mesuré dans les CNTP faut-il utiliser au cours de la
réaction si on utilise 19.5g du composé A ?
EXERCICE VI :
Un
flacon de verre de volume 10L contient du dichlore à la pression normale et à
la température de 27°C. On introduit dans le flacon quelques gouttes de benzène
puis on l’expose au soleil.
1)
Ecrire l’équation de la réaction qui se produit
2)
Nommer le produit obtenu. Quel est le nom de cette réaction ?
3)
Calculer la masse du produit obtenu sachant que le benzène est en excès.
On
donne : masse molaire Cl : 35.5 g/mol ; R = 8.31 constante
des gaz parfaits.
EXERCICE
II :
1.En
présence du chlorure d’aluminium, le dichlore réagit sur le benzène pour donner
le chlorobenzène. Quel volume de chlorure d’hydrogène (mesure dans les CNTP)
obtient-on par action du dichlore sur 11,7g de benzène ?
2.
le trinitrotoluène (TNT), explosif puissant, est préparé à partir de l’acide
nitrique.
a.
écrire l’équation de la réaction
b.
quelle masse de TNT peut-on obtenir a
partir de 23 kg de toluène ?
3.
La formule de dichlorodiphényltrichloroéthane (DDT)est présentée ci-dessous

a.
Déterminer sa masse molaire ainsi que
b.
Déterminer son pourcentage en masse de chlore.
c.
le DDT est interdit dans de nombreux pays car c’est un compose très toxique.
Une dose de 0,5 g par kg est mortelle pour l’homme.
Quelle
masse de DDT peut entrainer la mort d’un homme pesant 75 kg ?
EXERCICE III :
1.
On
réalise la dinitration du benzène (obtention du
dinitrobenzène).
a-Ecrire la formule semi
développée des composés susceptibles de se former.
b-On part de 50 g de
benzène. Déterminer la masse d’ortho, para, méta dinitrobenzène obtenue (on
suppose la réaction complète) sachant que leurs pourcentages dans le mélange
sont : 6% pour l’ortho dinitrobenzène 93% pour le méta dinitrobenzène 1% pour
le para dinitrobenzène.
2.
On
réalise la chloration du benzène, en présence de chlorure d’aluminium AlCl3.
La réaction est conduite de telle façon que son rendement par rapport au
benzène est de 80%. A partir de 3,0g de benzène, combien a-t-on obtenu de
monochlorobenzène (donner le résultat en mole et en gramme) ? On donne masse
molaire du benzène = 78 g/mol
3.On fait
réagir 5,0 g de toluène (C₆H₅CH₃)
avec du dichlore Cl₂ en présence de AlCl₃,
pour obtenir du chlorure de benzyle (C₆H₅CH₂Cl).
Le rendement de la
réaction est de 75 %.
Données :
- M(toluène) = 92
g/mol
- M(chlorure
de benzyle) = 126,5 g/mol
a. Écrire l'équation de
la réaction.
b. Calculer le nombre
de moles de toluène utilisées.
c. Calculer la quantité
(en mole) et la masse de chlorure de benzyle obtenue.
EXERCICE IV :
1.
On trouve dans le commerce des boules antimites constitues de
paradichlorobenzène (1,4-dichlorobenzene). Quelle masse de benzène est
nécessaire à la fabrication d’un sachet de 100 g de boules, sachant que la
réaction -a un rendement de 60%
2.
L’analyse de 12,3 mg d’un compose organique, de masse molaire 112,5 g.mol-1,
donne 289 mg de dioxyde de carbone et 4,9 mg d’eau. Par une méthode appropriée,
on transforme le chlore qu’il contient en chlorure d’argent, 8.7 mg du compose
donnent 11,1 mg de chlorure d’argent.
a- déterminer la formule brute et la formule développée du
compose étudier.
b-quelle masse de dichlore faut-il pour 8.7 mg de de compose
à partir du benzène ?
3.
le naphtalène réagit avec l’acide nitrique concentre, en présence d’acide
sulfurique concentre, en donnant un dérivé monosubstitué
Quelle
masse de ce compose nitre peut-on obtenir si on fait réagir de l’acide nitrique
en excès, sur 15 g de naphtalène, en admettant un rendement de 90% dans les
conditions de l’expérience.
EXERCICE
V :
1.
Le xylène est le nom courant du diméthylbenzène.
Combien a-t-il d’isomères ?
2. Le propène peut fixer une molécule de
chlorure d’hydrogène.
a)
Quelles sont les formules développées des deux produits que l’on peut obtenir ?
b)
En fait, on obtient un seul corps : le plus symétrique des deux. Donner son nom
systématique.
3.
Traité par le corps obtenu en 2- en présence de chlorure d’aluminium, le méta
xylène donne une réaction de substitution au cours de laquelle un groupe isopropyl remplace un atome d’hydrogène du cycle
benzénique.
a) Combien d’isomères peut-on obtenir ?
b)
Compte tenu de l’encombrement du groupe isopropyle,
quel sera l’isomère le plus abondant ?
4. La nitration de cet isomère conduit à un
produit dont la composition massique centésimale est la suivante : C : 46,6 % ;
H : 4,6 % ; N : 14,8 % ; 33,9 %. Déterminer sa formule brute, sa masse molaire
et sa formule développée
CORRIGES
EXERCICE I :
1. formules semi-développées des
hydrocarbures :
a) 1, 3, 5-trinitrobenzène
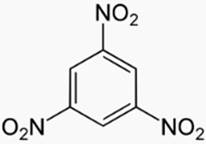
b) Orthodipropylbenzène
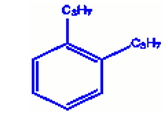
c) 1, 3, 5-trichlorobenzène
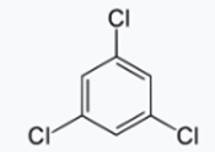
d) 2, 4, 6-trichlorotoluène

2.
a)
isomères aromatiques du diméthylbenzène.
Le xylène, ou diméthylbenzène, est un groupe d'hydrocarbures
aromatiques dérivés méthylés du benzène. Il est représenté par trois isomères structuraux :
1,2-diméthylbenzène, 1,3-diméthylbenzène et 1,4-diméthylbenzène (appelés
respectivement ortho-diméthylbenzène, méta-diméthylbenzène et para-diméthylbenzène).

b)
isomères de tétraméthylbenzène.
Le durène ou
1,2,4,5-tétraméthylbenzène est un hydrocarbure aromatique dérivé du benzène. C'est un intermédiaire dans la
synthèse de l'acide pyromellitique qui est utilisé
pour la fabrication d'agents de durcissement, de colles et
de matériaux de revêtement. Il est utilisé dans la fabrication de certaines
matières premières pour les plastiques techniques (polyimides) et d'agent de réticulation pour les résines glycéro
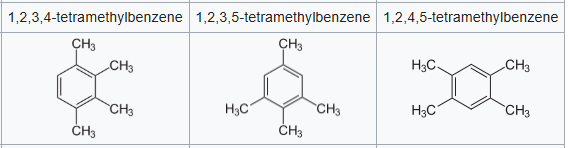
3.
formules semi-développées des composés ayant pour formules brutes C8H10.
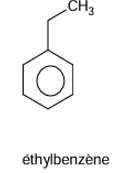

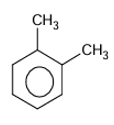


EXERCICE II :
1)
formule brute du
composé : CxHy
![]() =
=![]()
![]() =
=![]()
formule brute: C6H6
2)
a)
Nommons le corps A et donnons sa formule développée.
b)

C’est le benzène
b) équation de la réaction.

Nom de la réaction : hydrogénation
3) volume de dihydrogène
mesuré dans les CNTP
n=m/M=19,5/78=0,25
mol
n=V/Vm =>V=nVm=0,25x22,4=5,6 l
EXERCICE III:
1) équation de la réaction qui se produit

2) Nommons le produit obtenu : monochlorobenzène.
Chloration du benzène
3) masse du produit obtenu sachant que le benzène est en excès.
On donne : masse molaire Cl : 35.5 g/mol ; R = 8.31 constante des gaz parfaits
PV=nRT=>n=PV/RT=105X10.10-3/8,31x300=0,4
mol
M=nM=0,4x112,5=45
g
EXERCICE IV:
1.Calcul du volume de HCl
C6H6
+ Cl2 →C6H5Cl + HCl
1 mol
1mol 1mol 1mol
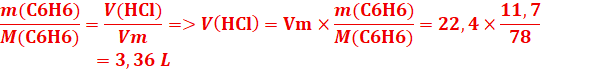
2.
a. Équation globale (simplifiée) :
C₆H₅CH₃ + 3 HNO₃ → C₆H₂(CH₃)(NO₂)₃ + 3 H₂O
(Toluène → TNT
b. Masses molaires
- Toluène (C₇H₈) : 92 g/mol
- TNT (C₇H₅N₃O₆) : 227
g/mol
Donc, 1 mole de toluène (92 g) donne 1 mole de TNT (227 g).
- 92 g de toluène → 227 g de TNT
- 23 000 g de toluène → x g de TNT
x = (227 × 23 000) / 92 ≈ 56
760 g = 56,76 kg
3. 354,5 g.mol-1 ;50,1% ;37,5 g.
a. Calcul de la masse molaire (M) du DDT :
- C (carbone) : 14 × 12,01 = 168,14 g/mol
- H (hydrogène) : 9 × 1,008 = 9,072 g/mol
- Cl (chlore) : 5 × 35,45 = 177,25 g/mol
Masse molaire totale ≈ 168,14 + 9,072 + 177,25 = 354,46
g/mol
b. Pourcentage massique de chlore dans le DDT :
%Cl = (177,25 / 354,46) × 100 ≈ 50,0 %II :
c. 0,5 g de DDT par kg de masse corporelle est
mortelle.
Homme de 75 kg :
- Masse mortelle = 0,5 g × 75 kg = 37,5 g
EXERCICE V :
1.
Formules semi développées des composés susceptibles de se
former.
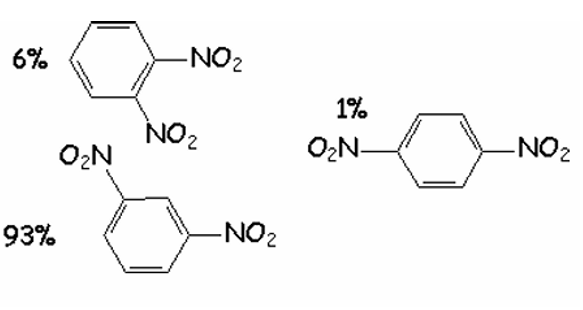
Calcul de
la masse totale de dinitrobenzène obtenue à partir de 50 g de benzène, en
supposant une nitration complète (ajout de deux groupes –NO₂) et un rendement de 100 %.
Données nécessaires
- Masse molaire du benzène (C₆H₆) = 78
g/mol
- Masse molaire du dinitrobenzène (C₆H₄(NO₂)₂) = 168
g/mol
- Masse de benzène utilisée = 50 g
- Pourcentages dans le mélange :
- ortho : 6 %
- méta : 93 %
- para : 1 %
·
Calcul du nombre de moles de benzène
n = m / M
= 50 / 78 ≈ 0,641 mol
Masse totale de dinitrobenzène produite
1 mol de benzène donne 1 mol de dinitrobenzène (réaction 1:1)
Donc :
0,641 mol de benzène → 0,641 mol de dinitrobenzène
m = n × M = 0,641 × 168 ≈
107,9 g
→
On obtient environ 108 g de dinitrobenzène (toutes formes confondues).
·
Répartition selon les isomères
- ortho : 6 % de 108 g = 6,48 g
- méta : 93 % de 108 g = 100,44 g
- para : 1 % de 108 g = 1,08 g
2.On chlorure 3,0 g de
benzène (C₆H₆) en présence de AlCl₃.
Le rendement est de 80
%.
On cherche la quantité de
monochlorobenzène (C₆H₅Cl)
obtenue, en mole et en gramme.
Données :
- M(Benzène) = 78
g/mol
- M(Monochlorobenzène) = 112,5 g/mol
·
Étapes de résolution :
Équation de la réaction
:
C₆H₆ + Cl₂ → C₆H₅Cl + HCl
C’est une réaction 1:1
(1 mol de benzène donne 1 mol de C₆H₅Cl)
·
Calcul du nombre de moles
de benzène :
n(C₆H₆) =
3,0 g / 78 g/mol = 0,0385 mol
3. Rendement de 80 % ⇒
moles de C₆H₅Cl
obtenues :
n(C₆H₅Cl)
= 0,0385 × 0,80 = 0,0308 mol
·
Masse de C₆H₅Cl obtenue :
m = n × M = 0,0308 mol
× 112,5 g/mol = 3,47 g
Réponse finale :
- n(C₆H₅Cl)
= 0,0308 mol
- m(C₆H₅Cl)
= 3,47 g
3.
a. Équation de la réaction :
C₆H₅CH₃ + Cl₂ → C₆H₅CH₂Cl
+ HCl
C’est une substitution radicalaire : un atome d’hydrogène sur le
groupement méthyle est remplacé par un atome de chlore.
b. Nombre de moles de toluène utilisées :
m = 5,0 g
M = 92 g/mol
n = m / M = 5,0 / 92 ≈ 0,054 mol
c. Rendement = 75 %
Si la réaction était totale, on obtiendrait :
n(théorique) = 0,054 mol de C₆H₅CH₂Cl
(car rapport 1:1)
Mais avec un rendement de 75 % :
n(réelle) = 0,75 × 0,054 ≈
0,0405 mol
Masse de chlorure de
benzyle obtenue :
M = 126,5 g/mol
m = n × M = 0,0405 × 126,5 ≈
5,12 g
EXERCICE VI :
1. Équation de la réaction (simplifiée) :
C₆H₆ + 2 Cl₂ → C₆H₄Cl₂ + 2 HCl
Un benzène donne un 1,4-dichlorobenzène (PDCB)
- Masse de PDCB produite : 100 g
- Masse molaire du PDCB = 147 g/mol
- Masse molaire du benzène = 78 g/mol
- Rendement : 60 % (soit 0,60)
Calcul de la quantité de PDCB
voulue (en mol)
n(PDCB) = 100 / 147 ≈ 0,680
mol
Comme le rendement est de 60 %, la quantité de benzène théorique
nécessaire est :
n(C₆H₆) = 0,680
/ 0,60 ≈ 1,133 mol
Masse de benzène nécessaire :
m = n × M = 1,133 × 78 ≈
88,4 g
2.
- Masse du composé analysé : 12,3 mg
- M (masse molaire) du composé : 112,5 g/mol
- CO₂ produit
: 289 mg
- H₂O
produite : 4,9 mg
- Masse de composé pour analyse du chlore : 8,7 mg
- Masse de AgCl obtenue : 11,1 mg
a) Détermination de la formule brute
Trouvons le nombre de moles de C, H, Cl
Carbone (C)
CO₂ contient
1 atome de C
M(CO₂) = 44
g/mol
→ moles de C = 289 mg / 44 g/mol = 6,57 mmol
Masse de C = 6,57 × 12 = 78,8 mg
Hydrogène (H)
H₂O
contient 2 atomes de H
M(H₂O) = 18
g/mol
→ moles d’H = (4,9 / 18) × 2 = 0,544 mmol
× 2 = 1,089 mmol
Masse d’H = 1,089 × 1 = 1,089 mg
Chlore (Cl) via AgCl
M(AgCl) = 143,5 g/mol
→ moles de AgCl =…
Convertissons les moles en ratios :
- C = 6,57 mmol
- H = 1,089 mmol
- Cl = 0,0774 mmol
Divisons par le plus petit :
- C = 6,57 / 0,0774 ≈ 85
- H = 1,089 / 0,0774 ≈ 14
- Cl = 0,0774 / 0,0774 = 1
→ Approximation : C₆H₅Cl
(rapport de C:H:Cl ≈ 6:5:1)
Vérifions la masse molaire
C₆H₅Cl → (6×12)
+ (5×1) + (1×35,5) = 72 + 5 + 35,5 = 112,5 g/mol
Conclusion :
- Formule brute : C₆H₅Cl
- Formule développée : c’est le chlorobenzène (un noyau
benzénique avec un Cl en substitution).
b) Quelle masse de dichlore (Cl₂) faut-il pour 8,7 mg de composé ?
Réaction :
C₆H₆ + Cl₂ → C₆H₅Cl
+ HCl
→ 1 mol de C₆H₆
nécessite 1 mol de Cl₂
Moles de C₆H₅Cl = 8,7 mg / 112,5 =
0,0773 mmol
Donc il faut 0,0773 mmol de Cl₂
Masse de Cl₂ = 0,0773
× 71 = 5,49 mg
Conclusion :
- Il faut environ 5,49 mg de Cl₂ pour obtenir 8,7 mg de chlorobenzène à partir du benzène
3. Pour résoudre cet exercice, on suit les étapes suivantes :
Données :
- Masse de naphtalène (C₁₀H₈) = 15 g
- Masse molaire du naphtalène = 128 g/mol
- Réaction : nitration du naphtalène → C₁₀H₇NO₂ (nitronaphtalène)
- Masse molaire de C₁₀H₇NO₂ = 173
g/mol
-
Rendement = 90%
·
Réaction chimique simplifiée :
C₁₀H₈ + HNO₃ →
C₁₀H₇NO₂ + H₂O
→ 1 mol de naphtalène donne 1 mol de nitronaphtalène
Calcul des moles de naphtalène :
n = 15 g / 128 g/mol = 0,1172 mol
·
Moles de nitronaphtalène obtenues
(avec 90% de rendement) :
n(produit)
= 0,1172 × 0,90 = 0,1055 mol
·
Masse obtenue de nitronaphtalène :
m = 0,1055
mol × 173 g/mol = 18,26 g
Résultat final :
On peut obtenir environ 18,26 g de nitronaphtalène
à partir de 15 g de naphtalène avec un rendement de 90
EXERCICE VII:
1. Le xylène a trois isomères structuraux :
1,2-diméthylbenzène, 1,3-diméthylbenzène et 1,4-diméthylbenzène (appelés
respectivement ortho-diméthylbenzène, méta-diméthylbenzène et para-diméthylbenzène).
2. Le propène peut fixer
une molécule de chlorure d’hydrogène.
a) formules développées des deux produits que l’on peut obtenir
CH3-CH=CH2 + HCl →
CH3-CHCl-CH3 ou CH3
-CH2-CH2Cl
b) le plus symétrique des deux est :
CH3-CHCl-CH3 2-chloropropane
3.
a) Voici les isomères
possibles issus de la réaction du méta-xylène (1,3-diméthylbenzène) avec le
2-chloropropane (CH₃–CHCl–CH₃) en présence
d’un catalyseur (AlCl₃) :
Rappel :
Le méta-xylène a des groupes CH₃ en positions 1 et 3 sur le noyau benzénique.
L’isopropyle (–CH(CH₃)₂), obtenu par alkylation, peut s’ajouter
sur les positions 2, 4, 5 ou 6, en tenant compte des effets directeurs des CH₃.
Isomères possibles (triméthylbenzènes
ramifiés) :
1,3-diméthyl-2-isopropylbenzène
1,3-diméthyl-4-isopropylbenzène
1,3-diméthyl-5-isopropylbenzène (produit principal, positions
para et ortho activées)
1,3-diméthyl-6-isopropylbenzène
Ces isomères sont tous des isomères de position (même formule
brute, groupements situés à des positions différentes sur le noyau aromatique)
Le produit principal est un triméthylbenzène
substitué par un groupe isopropyle (–CH(CH₃)₂) sur le noyau aromatique.
CH3
|
/¯¯¯¯¯¯\
CH3–|
|–CH(CH3)2
\___
_/
Explication
:
- Le méta-xylène a deux groupes –CH₃ en position 1 et 3.
- L'isopropyle (issu du
2-chloropropane) vient s’ajouter en position 5 (par rapport au groupe 1),
dirigé par les deux CH₃.
- Le composé obtenu est 1,3-diméthyl-5-isopropylbenzène
b)
Compte tenu de l’encombrement stérique du groupe isopropyle (–CH(CH₃)₂), l’isomère le plus abondant sera celui où
ce groupe se fixe le plus loin possible des deux groupes méthyles (–CH₃) déjà présents sur le méta-xylène.
Raisonnement :
Le méta-xylène a ses deux groupes CH₃ en positions 1 et 3.
Le groupe isopropyle, issu de
l’alkylation, s'ajoute préférentiellement en position :
C’est la position para par rapport au CH₃ en position 1, et méta par
rapport au CH₃ en
position 3.
➤ C’est la moins encombrée.
Conclusion :
L’isomère 1,3-diméthyl-5-isopropylbenzène sera le plus abondant,
car il minimise les répulsions stériques entre les substituants.
Formule brute : C₁₁H₁₆
4. formule brute : CxHyNzOt
Données :
- C : 46,6 %
- H : 4,6 %
- N : 14,8 %
- O : 33,9 %
![]() =
=![]()
![]() =
=![]()
![]() =
=![]()
![]() =
=![]()
-
C ≈ 11
-
H ≈ 13
-
N = 3
-
O ≈ 6
Donc formule brute probable : C₁₁H₁₃N₃O₆
Masse molaire :
- C₁₁ : 11 ×
12 = 132
- H₁₃ : 13 × 1
= 13
- N₃ : 3 × 14
= 42
- O₆ : 6 × 16
= 96
Masse molaire ≈ 132 + 13 + 42 + 96 = 283 g/mol
Formule développée
possible :
Le composé de départ est 1,3-diméthyl-5-isopropylbenzène (C₁₁H₁₆). Une nitration remplace un atome H du noyau
aromatique par un groupe –NO₂.
Mais ici, on a 3 atomes d'azote et 6 d'oxygène, soit 3 groupes
–NO₂
Donc : le composé obtenu
est probablement un dérivé trinitré du diméthylisopropylbenzène.
Nom :
1,3-diméthyl-5-isopropyl-2,4,6-trinitrobenzène
C'est un dérivé de type trinitrotoluène modifié
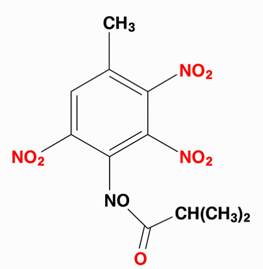
Avez-vous
un exercice à proposer ?Cliquez-ici
Merci de votre visite
Laissez un commentaire