ALCENES-ALCYNES
FORMULES GENERALES-NOMENCLATURE -ISOMERIE
Formules
générales
Ø
Les
alcènes sont des hydrocarbures a chaine ouverte comportant une double
liaison. Ils possèdent au moins deux atomes de carbone. A cause de la double
liaison, un alcène possède deux atomes d’hydrogène de moins que l’alcane ayant
le même nombre d’atomes de carbone.
La
formule générale des alcènes est : CnH2n avec n≥2
Remarque :
CnH2n
est aussi la formule générale des cyclanes qui sont des isomères d’alcènes.
Ø
Les
alcynes sont des hydrocarbures a chaine ouverte comportant une triple
liaison. Un alcyne possède donc 2 atomes d’hydrogène de moins que l’alcène
ayant le même nombre d’atome de carbone.
La formule générale des alcynes est : CnH2n-2
Remarque :
CnH2n-2
est aussi la formule générale des diènes, hydrocarbure a chaine ouverte
possédant 2 doubles liaisons. Les diènes sont des isomères d’alcynes.
Structure des alcènes
Un exemple d’alcène : l’éthylène
L’éthylène C2H4
est un gaz dans les conditions normales de température et de pression. La
molécule est plane et comporte une double liaison.
La
formule développée peut s’écrire :
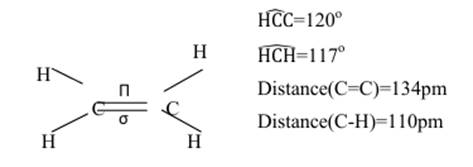
Les
deux liaisons composant la liaison éthylénique ne sont pas équivalentes :
-l’une
solide, présentant une symétrie de révolution autour de l’axe C-C : c’est
la liaison sigma ![]() .
.
-l’autre,
beaucoup plus fragile et donc facile à rompre : c’est la liaison pi ![]()
Lorsqu’un atome de carbone est lie à 3
atomes avec lesquels il échange 2 liaisons simples et une double, les angles
entre les liaisons valent 120![]() . On dit que le carbone
est trigonal, la double liaison entraine la rigidité de de la molécule ;
la libre rotation est impossible autour de la liaison C-C.
. On dit que le carbone
est trigonal, la double liaison entraine la rigidité de de la molécule ;
la libre rotation est impossible autour de la liaison C-C.
Structure des alcynes
Exemple d’alcyne : acétylène
L’acétylène C2H2 est un
gaz dans les conditions normales de température et de pression. Les deux atomes
de carbone établissent entre eux trois liaisons covalentes (liaison
acétylénique).
La
formule développée peut s’écrire :

Les trois liaisons ne sont pas équivalentes. Il
existe une liaison sigma ![]() solide et deux liaisons pi
solide et deux liaisons pi ![]() fragiles.
fragiles.
L’étude
de la structure géométrique de la molécule montre que :
-la
molécules est linéaire : les centres des 4 atomes sont alignés.
-la
longueur de la triple liaison C≡C aut 120pm,
donc inférieure à celle de la double liaison ;
-
la longueur des liaisons C-H vaut 110pm.
Lorsqu’un
atome de carbone est lié à deux atomes par une simple et une triple liaison,
les centres des trois atomes sont alignés : le carbone est digonal.
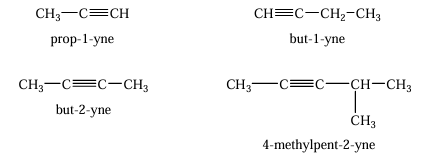
Nomenclature des alcènes et des alcynes
Le nom d’un alcène ou d’un alcyne s’obtient à
partir du nom de l’alcane correspondant en remplaçant la terminaison ane de l’alcane respectivement par -éne ou -yne,
précédée entre tiret de l’indice de position de la double ou triple liaison. La
position de la double liaison ou celle de la triple liaison est indiquée par le
numéro de l’atome de carbone doublement ou triplement lié, possédant l’indice
le plus petit. La chaine principale est celle la plus longue contenant la
double ou triple liaison.
Nomenclature des alcènes
Étapes
de Nomenclature :
- Identifier la plus
longue chaîne carbonée contenant la double liaison.
- Numéroter la
chaîne principale : En partant de l'extrémité la plus proche de la
double liaison (qui est en position 1).
- Identifier les
substituants et leur position.
- Assembler le nom
: indice-substituant + nom de la chaîne principale avec indice de la
double liaison + suffixe -ène
Nomenclature des alcynes
Étapes
de Nomenclature :
- Identifier la plus
longue chaîne carbonée contenant la triple liaison.
- Numéroter la
chaîne principale : En partant de l'extrémité la plus proche de la
triple liaison.
- Indiquer la
position de la triple liaison et le suffixe : -1-yne.
- Assembler le nom
: nom de la chaîne principale + indice de la triple liaison + suffixe
-yne
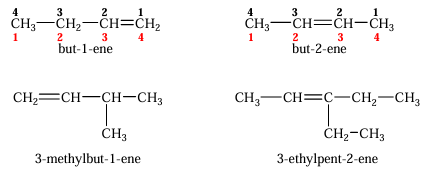
Isoméries
Ø Isomérie de
constitution
-isomérie de
position : les isomères ne diffèrent que par la position de la liaison
multiple.
Exemples :
Isomères de position :
le but-1-éne (CH2=CH-CH2-CH3) et le but-2-éne
(CH3-CH=CH-CH3)
-isomères de chaine : les isomères ne diffèrent que par leur chaine carbonée.
Exemples :
Isomères de chaine. -Le but-1-éne (CH2=CH-CH2-CH3)
et le 2-méthylprop-1-éne (CH3-C(CH3)=CH2 )
-le but-2-éne
(CH3-CH=CH-CH3 ) et le 2-méthylprop-1-éne (CH3-C(CH3)=CH2 ).
Ø Stéréo-isomérie :
Les stéréo-isomères sont des isomères qui ne
diffèrent que par l’agencement spatial des atomes. La stéréo-isomérie se
rencontre chez les alcènes.
Si nous considérons le
but-2-éne, la molécule peut se présenter dans l’espace sous deux formes
appelées configurations
- Il existe deux isomères :
- Z-but-2-ène (Z de l’allemand Zusammen) : les groupes identiques (CH₃) sont du même côté de la double liaison.
- E-but-2-ène (E de l’allemand Entgegen) : les groupes identiques (CH₃) sont de côtés opposés.
|
CH₃ H \
/ C = C /
\ H
CH₃ Z (cis) |
CH₃ CH3 \ / C = C / \ H H E (trans) |
Remarques :
§ Les configurations Z/E
sont appelées des diastéréoisomères,
§ L’isomérie Z/E était
autrefois appelée isomérie Cis/trans. On rencontre parfois cette appellation
lorsque les substituants des deux carbones doublement liés sont les mêmes.
PROPRIETES PHYSIQUES
Dans les conditions normales :
§ Les alcènes et les
alcynes de C2 à C4 sont gazeux, de C5 à C18
les alcènes sont liquides alors que les alcynes eux sont liquides de C5
à C15. Les autres alcènes et alcynes sont solides.
§ Ces hydrocarbures ne
sont généralement pas solubles dans l’eau ou le sont peu.
PROPRIETES CHIMIQUES
Combustion complète dans le dioxygène
Cas des alcènes : CnH2n
+ O2 → nCO2 + nH2O
Cas des alcynes : CnH2n-2 +
O2 → nCO2 + (n-1) H2O
Réaction d’addition
Une réaction d’addition est une réaction
chimique au cours de laquelle deux réactifs s’unissent pour former un seul
produit, sans perte d’atome.
Elle concerne généralement les molécules possédant une
double liaison (comme les alcènes) ou une triple liaison. Les liaisons pi sont
fragiles et peuvent se rompre facilement. Lorsqu’une liaison pi s’ouvre,
chaque atome de carbone dispose d’un électron célibataire qu’il peut engager
dans une liaison avec un autre atome.
Caractéristiques
:
-
Un seul produit final.
-
Pas de sous-produits.
-
Typique des réactions sur des liaisons multiples.
Hydrogénation
L’hydrogénation d’un alcène nécessite
l’utilisation d’un catalyseur : le nickel et le palladium.
Cas
des alcènes
En
présence du nickel, l’éthylène réagit avec le dihydrogène pour donner de
l’éthane.
Exemple:
CH2 = CH2 + H2 →
CH3─ CH3
Au
cours de cette réaction, il y a eu ouverture de la liaison π. Chaque atome
de carbone a engagé son électron célibataire disponible dans une liaison avec
un atome d’hydrogène.
Cas
des alcynes
- l’hydrogénation de
l’acétylène conduit à l’éthylène en présence du palladium (Pd),
Exemple :
![]()
-Avec
le nickel, la réaction se poursuit et conduit à l’éthane
![]()
L’hydrogénation d’un alcyne conduit à un
alcane, il faut 2 molécules de dihydrogène.
En
général, l’hydrogénation d’un alcyne conduit à un alcène (hydrogénation
incomplète) et à un alcane (hydrogénation complète). Les équations-bilans
générales de l’hydrogénation des alcynes s’écrivent :
CnH2n-2 + H2 →
CnH2n
CnH2n-2 + 2H2
→ CnH2n+2
En présence du palladium, la réaction s’arrête
au stade d’alcène.
Halogénation
L’addition d’un halogène sur un alcène
lorsqu’elle est possible donne un alcane dihalogéné
et sur un alcyne lorsque la réaction est possible se fait avec fixation d’une
molécule de X2 (X=Cl, Br,…).
Addition
du dichlore sur l’éthylène
CH2= CH2 + Cl2
→ CH2Cl= CH2Cl (1,2-dichlorométhane)
On
obtient un liquide huileux, le 1,2-dichlorométhane.
Cette
réaction, appelée la chloruration est, comme l’hydrogénation, une
réaction d’addition qui s’accompagne d’un profond changement de structure.
Addition
du dibrome sur l’éthylène
On
obtient du 1,2-dibromoethane, CH2Br-CH2Br
Hydratation
Cas des alcènes :
L’action
de l’eau sur les alcènes est généralement possible à haute température, en
présence du catalyseur l’acide sulfurique. Elle conduit à la formation d’un
alcool.
CH2=
CH2 + H2O →CH3-CH2OH
CH3-CH2-CH=CH2
+ H2O CH3-CH2-CH2-CH2OH ou CH3-CH2-CHOH-CH3
Remarque
:
Dans le premier exemple où l’alcène est
symétrique, on obtient un seul produit et dans le second cas où l’alcène est
dissymétrique, l’hydratation conduit à deux produits dont l’un est majoritaire
et l’autre minoritaire.
Règle
de Markovnikov
: Lors de l’addition de HO-H sur un alcène dissymétrique, l’atome d’hydrogène
se fixe sur l’atome de carbone le plus hydrogéné (moins substitué)
Cas
des alcynes
En
présence de l’ion mercure (Hg2+), l’addition de l’eau sur un alcyne conduit à
une cétone et dans un cas particulier de l’acétylène à un aldéhyde.
CH≡C-CH3
+ H2O ⎯⎯ CH3-CO-CH3
(propanone)
CH≡CH + H2O
⎯⎯ CH3-CHO (éthanal)
Comme
l’addition d’eau sur un alcène, celle d’un alcyne aussi suit aussi la règle de
Markovnikov.
Addition d’un hydracide halogéné : H-X
L’addition d’un hydracide halogéné H-X (X=Cl, Br,…) sur un alcène ou un alcyne se fait par fixation d’une
molécule sur la double ou triple liaison.
Cas
des alcènes
L’addition de chlorure d’hydrogène sur
l’éthylène conduit au chlorométhane.
CH2=CH2 + HCl
→ CH3-CHCl
Cette
réaction se produit avec les autres alcènes.
CH3-CH=CH2
+ HCl → CH3-CHCl-CH3 ou CH3 -CH2-CH2Cl
L’expérience
montre qu’on obtient principalement le 2-chloropropane dans lequel l’hydrogène
s’est fixé sur le carbone le plus hydrogéné.
Cas
des alcynes
Dans
le cas d’un alcyne on peut avoir fixation de deux molécules de HCl.
CH≡C-CH3
+ HCl → CH2=CCl-CH3 ou CHCl=CH-CH3
CH≡C-CH3
+ 2HCl → CH3-CCl2-CH3 ou CH2Cl-CHCl-CH3
Réaction
de polymérisation
C’est
l’addition répétée (polyaddition) d’un très grand nombre de molécules
insaturées identiques (monomères). Elle conduit à une macromolécule (polymère).
Le monomère doit contenir au moins une liaison C=C.
Polymérisation
de l’éthylène
n(CH2=CH2) →
(-CH2-CH2-)n : Polyéthylène où n est le degré de
polymérisation,
-CH2-CH2- : le motif
Les
polyéthylènes sont des thermoplastiques : ils deviennent fluides lorsqu’on
les chauffe, ce qui permet de leur donner une forme.
Selon
les conditions expérimentales, on obtient :
-le
polyéthylène basse densité obtenu à haute pression utilise pour fabriquer des
emballages souples (sachets d’emballage, bouteilles, isolants électriques…)
-
le polyéthylène basse densité obtenu à pression peu élevée utilise pour
fabriquer des casiers, des futs, des jouets
Polymérisation
du chlorure de vinyle
Le chlorure de vinyl
CH2=CHCl possède une double liaison,
comme l’éthylène. Il se polymérise en donnant le Polychlorure de vinyl (PCV).
n(CH2=CHCl) → (-CH2-CHCl-) Polychlorure de vinyl (PCV)
L'équation
de polymérisation du chlorure de vinyle (aussi appelé chloroéthène)
est une réaction d’addition de plusieurs molécules de monomère de chlorure de
vinyle pour former le polychlorure de vinyle (PVC).
Équation
générale :
n CH₂=CHCl → [–CH₂–CHCl–]ₙ
-
CH₂=CHCl : chlorure de
vinyle (monomère),
-
[–CH₂–CHCl–]ₙ
: polychlorure de vinyle (polymère),
-
n : nombre de molécules (grand nombre)
Polymérisation du styrène
Le styrène se polymérise pour donner le
polystyrène. Sous sa forme expansée, il est utilisé dans l’emballage des objets
fragiles.
L’équation
de la polymérisation du styrène est la transformation de molécules de styrène
(monomères) en polystyrène (polymère).
Équation
générale :
n C₆H₅-CH=CH₂
→ [–CH₂–CH(C₆H₅)–]ₙ
-
C₆H₅-CH=CH₂
: formule du styrène (ou phényléthène),
-
[–CH₂–CH(C₆H₅)–]ₙ : structure répétitive
du polystyrène,
-
n : nombre de monomères
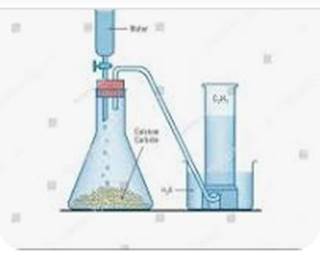
PREPARATION DE L’ACETYLENE AU LABORATOIRE
L’acétylène
est obtenu au laboratoire par action de l’eau sur le carbure de calcium (C2Ca).
L’équation-bilan
de la réaction s’écrit :
CaC2 + 2H2O→C2H2
+ Ca(OH)2
EXERCICES
EXERCICE
I : nommer
les hydrocarbures suivants, et donner leurs formules brutes
1.
![]()
2.
![]()
3.
![]()
4.
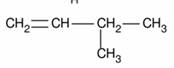
5.
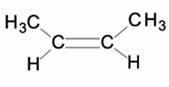
EXERCICE
II : écrire
les formules semi-développées des hydrocarbures suivants :
1.
but-1-yne
2.
pent-1-yne
3.
pent-2-yne
4.
3-chloro-5-isopropyl-3-méthyloct-1-yne
5.
4-éthylhex-2-yne
EXERCICE III
Soit A un hydrocarbure
aliphatique insaturé, de masse molaire M=68g⋅mol−1, dont la chaine carbonée renferme une triple liaison.
a) Trouver la formule brute de l'hydrocarbure A.
b) trouver tous les isomères possibles de A et les nommer.
On donne :
M(H)=1g⋅mol−1 et M(C)=12g⋅mol−1
EXERCICE
IV :
On
réalise la chloration d’un alcène A dans une industrie chimique. Le produit B
obtenu a une masse molaire égale à 113g/mol. Un élève veut établir la formule
brute du produit B et celle de l’alcène A. Il éprouve des difficultés.
Viens-lui-en aide pour répondre aux questions suivantes.
1-
Ecris l’équation bilan générale de la chloration des alcènes.
2-
Exprime la masse molaire de B en fonction de n (nombre d’atomes de carbone de A
et B)
3-
Trouve le nombre d’atones de carbone n.
4-
Etablis la formule brute de B et celle de A.
On donne : M (H) = 1g/mol; M(C) = 12g/mol; M (Cl) = 35,5g/mol.
EXERCICE
V :
1
Donner la formule brute d’un alcyne dont la molécule renferme n atomes de carbone.
Exprimer en fonction de n le pourcentage en masse de l’élément d’hydrogène
(%H).
2.
L’analyse de 4,5g de l’alcyne montre qu’il renferme 0,45g d’hydrogène. En
déduire sa formule moléculaire A, ainsi que sa formule semi-développée et son
nom.
3.
On lui additionne du dichlore, on obtient un dérivé saturé B. Ecrire son
équation-bilan en précisant la formule semi-développée et le nom du composé B.
4.
On fait barboter l’alcyne précédent dans l’eau (H2O) à 700 C en
présence de l’oxyde de mercure II (HgO) et de l’acide
sulfurique. On obtient un composé organique C contenant un atome d’oxygène
appelé composé carbonylé.
4.1.
Ecrire l’équation-bilan de la réaction.
4.2.
Donner la famille à laquelle appartient ce composé carbonylé.
5.
Donner le nom de l’alcène D qui dérive de A, ainsi que son équation-bilan.
6.
Ecrire l’équation-bilan de la réaction d’hydratation de D.
7.
Ecrire l’équation-bilan de la réaction de polymérisation de cet alcène en
nommant le(s) produit(s) et le(s) réactif(s).
EXERCICE
VI :
Un hydrocarbure A contient en masse 6 fois plus de
carbone que d'hydrogène.
1) a) Déterminer la formule brute générale de cet
hydrocarbure.
b) A quelle(s) famille(s)
d'hydrocarbure appartient-il ?
c) Écrire les formules
semi-développées possible de A sachant que A renferme 8 atomes
d'hydrogène.
2) La chaine carbonée de l'hydrocarbure A est linéaire ; de plus A possède
des stéréo-isomère Z/E.
Représenter ces stéréo-isomères.
3) Le craquage de A dans un vapocraqueur
conduit à la formation de l'éthylène.
a) Toute la quantité de A n'a pas été transformée, déterminer la composition
centésimale molaire du mélange gazeux du vapocraqueur à la fin de la réaction
sachant que sa densité par rapport à l'air est d=1.2068.
b) Après refroidissement du
mélange, on y ajoute du dichlore ; puis on place le nouveau mélange à
l'obscurité.
Écrire les formules
semi-développées et les noms des produits B et C formés.
B étant le
produit issu de l'action du dichlore sur A.
c) Le chauffage des produits B et C provoque
l'élimination d'une molécule de chlorure d'hydrogène HCl.
Le composé C donne le
composé D et le chlorure d'hydrogène.
EXERCICE VII :
1) Un hydrocarbure aliphatique saturé (A) a une masse molaire moléculaire M=58g⋅mol−1.
a) Trouver la formule brute de (A)
b) Écrire les formules semi-développées possibles et
donner le nom des différents isomères de (A).
c) Identifier l'isomère (A1) de (A) sachant qu'il présente une chaine ramifiée.
2) l'action du dibrome Br2 sur l'hydrocarbure (A1) en présence de la lumière, donne un
mélange de dérivés bromés dont l'un est un dérivé dibromé
noté (B)
a) Écrire l'équation chimique de la réaction
conduisant à la formation de (B) en utilisant
les formules brutes.
b) Donner toutes les formules semi-développées
possibles de (B) et le nom des isomères
correspondants
c) La structures de l'hydrocarbure de départ (A1) a-t-elle été modifiée au cours de cette réaction.
3) L'un des isomères (B1) de (B) peut être obtenu par une réaction d'addition du dibrome sur un alcène.
a) Trouver la formule brute de cet alcène.
b) Écrire la formule semi développée et le nom de cet
alcène.
c. Écrire l'équation de la réaction d'addition en
utilisant les formules brutes.
d) la structure de l'hydrocarbure de départ a-t-elle
été modifiée au cours de cette réaction ?
CORRIGES
EXERCICE I : nommer les hydrocarbures
suivants, et donner leurs formules brutes
1.
Nom : 2-methylprop-1-ene
Formule brute : C4H8
2.
Nom : but-2-ene
Formule brute : C4H8
3.
Nom : 3-méthylbut-1-yne
Formule brute : C5H8
4.
Nom : 3-methylbut-1-ene
Formule brute :C5H11
5.
Nom : (Z)-but-2-ene
Formule brute :C4H8
EXERCICE II :
1. CH2=CH-CH2CH3
2.
![]()
3.
![]()
4.
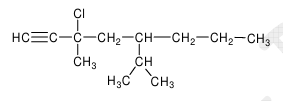
5.
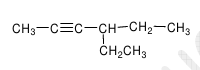
EXERCICE
III
a) formule brute de l'hydrocarbure A.
CnH2n-2
M=12n+2n-2=14n-2=68
=>n=70/14=>n=5
A :
C5H8
b) isomères
possibles de A et les nommer.
![]() pent-1-yne
pent-1-yne
![]() pent-2-yne
pent-2-yne
EXERCICE IV :
1- Equation bilan générale CnH2n + Cl2
→ CnH2nCl2
2- J’exprime la masse molaire de B en fonction de n. A a pour formule brute : CnH2n
B résulte de l’addition du dichlore Cl2 sur A ; il a
donc pour formule : CnH2nCl2
M (B) = M (CnH2nCl2) =14n+71
3- Je trouve le nombre d’atones de carbone n.
113= 12n + (1x2n) + (35,5x2) 113=14n +71;
14n = 42
14n = 42 ; n=42 14 ; n= 3
4- J’établis la formule brute de B et celle de A.
n= 3;
B:
C3H6Cl2;
A: C3H6
EXERCICE V :
1. Alcyne
A: CnH2n-2
M(A)=12n +2n-2=14n-2
M(H)=2n-2
![]()
![]() =
=![]()
Formule
de A :C3H4, nom: propyne, FSD: CH3-C≡CH
3. CH3-C≡CH + 2Cl
→ CH3-C(Cl2)-CHCl2 (B)
(B): 1,1-dichloro-2,2-dichloropropane
4.1. CH3-C≡CH3
+ H2O → CH3-CO-CH3 (C): propanone
4.2. Ce composé appartient à la famille des cétones
5. CH3-C≡CH3
+ H2 → CH3-CH=CH2 (D): propéne
6. CH3-CH=CH2 + H2O
CH3CH(OH)-CH3: propan-2-ol CH3-CH2-CH2OH:
propan-1-ol
7. n(CH3-CH=CH2)
→ (-CH-CH-)n: polypropéne
EXERCICE VI :
1) a) formule brute générale de cet
hydrocarbure.
Formule : CxHy avec mC=6mH
Soit la formule brute : CₓHᵧ
- Masse du carbone = 12x
- Masse de l’hydrogène = y
On
dit :
> Masse du carbone = 6 × Masse de l’hydrogène
Donc :
12x = 6y
⇒ x = n =>y=2n
formule brute générale : CₙH₂ₙ
b) A quelle(s) famille(s) d'hydrocarbure appartient-il
?
- des alcènes
(hydrocarbures avec une double liaison)
- ou des cycloalcanes
(hydrocarbures cycliques saturés)
c) Écrire les formules semi-développées possible
de A sachant que A renferme 8 atomes d'hydrogène.
Ce composé peut être :
·
Un alcène (double liaison, chaîne
ouverte) :
- but-1-ène : CH₂=CH–CH₂–CH₃
- but-2-ène
: CH₃–CH=CH–CH₃
- cis-but-2-ène et trans-but-2-ène (isomères géométriques)
·
Un cycloalcane (cycle saturé) :
- cyclobutane
: un cycle de 4 carbones
- méthylcyclopropane : un
cycle de 3 carbones + 1 ramification CH₃
2) La chaine carbonée de l'hydrocarbure A est linéaire ; de plus A possède
des stéréo-isomère Z/E.
- C’est un alcène (présence d’une double liaison C=C)
- Chaque carbone de la double liaison porte deux
groupes différents, condition nécessaire à l’existence de stéréo-isomères
géométriques (Z/E)
L'hydrocarbure A est donc but-2-ène : CH₃–CH=CH–CH₃
Représentations des stéréo-isomères :
·
Isomère Z (zusammen
= ensemble)
Les deux
groupes identiques (CH₃) sont du même côté de la double
liaison.
CH3 CH3
\
/
C =
C
/
\
H
H
Z-but-2-ène :
·
Isomère E (entgegen
= opposé)
Les deux
groupes CH₃ sont de côtés opposés.
CH3 H
\
/
C = C
/
\
H
CH3 E-but-2-ène
3) Le craquage de A dans un
vapocraqueur conduit à la formation de l'éthylène.
Le craquage du but-2-ène peut être schématisé par :
C₄H₈ → C₂H₄ + C₂H₄
(1 mol de C₄H₈ donne 2 moles d’éthylène)
a) Pour déterminer la composition centésimale molaire
du mélange gazeux final (après craquage partiel de A en éthylène), on utilise
la densité par rapport à l’air.
M_mélange = d × M_air = 1,2068 ×
29 ≈ 35 g/mol
Hypothèse de craquage
On suppose :
- n mols de C₄H₈ initialement
- x mols ont été craqués
→ il reste n – x mols de C₄H₈
- 2x mols de C₂H₄ produits
→ Total de mols : (n –
x) + 2x = n + x
Masse molaire moyenne
M_mélange = (n–x)×M(C₄H₈) + 2x×M(C₂H₄) / (n + x)
- M(C₄H₈) = 56 g/mol
- M(C₂H4)=28g /mol
M_mélange = [(n–x)×56 + 2x×28] / (n +
x)
35=[56n-56x+56x]/(n+x)
35=56n/(n+x)
Pour n=1 mol
x=0,6 mols
Restant de C₄H₈ :0,4 mol
C₂H₄ formé : 1,2 mols
Total :1,6 mol
→ Pourcentage molaire :
- C₄H₈ : (0,4 / 1,6) × 100 = 25%
- C₂H₄ : (1,2 / 1,6) × 100 = 75%
b)
B étant le
produit issu de l'action du dichlore sur A.
Puisque A est un alcène de chaîne linéaire avec 8
hydrogènes et qu'il présente des isomères Z/E, il s'agit probablement de
but-2-ène (C4H8).
Réaction de A
avec Cl₂ à l'obscurité
Quand on ajoute du dichlore (Cl₂) à un alcène en absence de lumière :
- Il n’y a pas de substitution radicalaire
- Il se produit une addition électrophile : les deux
atomes de chlore s’ajoutent sur la double liaison.
Réaction de Cl₂ sur le but-2-ène (A)
Formule semi-développée de A :
CH₃–CH=CH–CH₃ (but-2-ène)
Réaction :
CH₃–CH=CH–CH₃ + Cl₂ → CH₃–CHCl–CHCl–CH₃
Produit B :
- Nom : 2,3-dichlorobutane
- Formule semi-développée : CH₃–CHCl–CHCl–CH₃
Produit C : CH2Cl-CH2Cl
c) Le chauffage des produits B et C provoque
l'élimination d'une molécule de chlorure d'hydrogène HCl.
Le composé C donne le
composé D et le chlorure d'hydrogène.
Lorsqu’on chauffe les produits B et C (2,3-dichlorobutane), il
peut se produire une élimination de HCl, typique
d’une réaction d’élimination de type E2, qui régénère une double liaison
(formation d’un alcène).
Réaction d’élimination sur C
C : 2,3-dichlorobutane :
CH₃–CHCl–CHCl–CH₃
Élimination de HCl → perte d’un
H sur un carbone et d’un Cl sur l’autre → formation d’une double liaison
entre C2 et C3.
Produit D obtenu :
CH₃–CH=CH–CH₃
Donc : D = but-2-ène, l’alcène de départ (rétro-élimination).
Bilan de la réaction :
C (2,3-dichlorobutane) → D (but-2-ène) + HCl
Cela montre que la réaction d’addition Cl₂ sur l’alcène est réversible par
chauffage (élimination)
EXERCICE VII :
1) Un hydrocarbure aliphatique saturé (A) a une masse molaire moléculaire M=58g⋅mol−1.
a) formule brute de (A)
CnH2n+2
M=12n+2n+2=14n+2=58 =>n=56/14=4
Formule brute de (A) : C4H10
b) formules semi-développées possibles et noms des
différents isomères de (A).

c)
l'isomère (A1) de (A) qui présente une chaine ramifiée.
A1 :
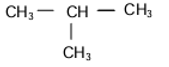
L’hydrocarbure (A1) est le 2-méthylpropane
2)
a) Réaction avec le dibrome
(Br₂) en présence de lumière :
→ Il s'agit d’une réaction de substitution radicalaire
(halogénation) sur un alcane ramifié, sous l’effet des UV.
Le Br₂ remplace deux atomes d’hydrogène pour donner un dérivé dibromé
(B).
Formule brute de la réaction :
C4H10 + Br2 → C4H8Br2
+ H2
Cela représente la formation d’un dibromo-dérivé
à partir de 2-méthylpropane, avec élimination de 2 atomes d’hydrogène
(remplacés par 2 Br).
Exemple de dérivé possible (B) :
Un des produits est : 1,2-dibromo-2-méthylpropane
b) Donner toutes les formules semi-développées
possibles de (B) et le nom des isomères
correspondants
À partir du 2-méthylpropane (C4H10),
on peut former plusieurs dérivés dibromés notés (B)
par substitution de deux atomes d'hydrogène par deux atomes de Br en présence
de lumière (halogénation radicalaire).
Formule du 2-méthylpropane :
CH3
|
CH3 – CH – CH3
On identifie les positions où les hydrogènes peuvent
être substitués par des Br :
- Carbone central (tertiaire) → 1 H
- Carbones terminaux (méthyle) → 6 H (3 sur
chaque CH3)
Formules semi-développées possibles de (B) :
CH3–C(Br)(CH3)–CH2Br → Nom : 1-bromo-2-bromo-2-méthylpropane
CH3–C(Br2)(CH3)–CH3 → Nom :
2,2-dibromo-2-méthylpropane
(2 Br sur le
même carbone central)
BrCH2–C(CH3)2–CH3 → Nom :
1-bromo-2-méthylpropane-2-yl bromide (forme
équivalente au 1er isomère)
c)
Oui, la structure de l'hydrocarbure de départ (A1),
qui est le 2-méthylpropane (C4H10), a été modifiée au
cours de la réaction.
Explication :
- La réaction avec le dibrome
(Br2) en présence de lumière est une substitution radicalaire.
- Elle remplace un ou plusieurs atomes d'hydrogène de
la molécule par des atomes de brome.
- Le squelette carboné reste le même (la chaîne carbonée
n’est pas rompue ni réorganisée), mais la nature des atomes liés au squelette
change, ce qui modifie la structure chimique de la molécule.
Donc :
- Structure globale (chaîne) : inchangée
- Structure moléculaire (liaisons et atomes présents)
: modifiée
3) a)
Pour obtenir l’isomère dibromé
(B1) à partir d’une réaction d’addition du dibrome
(Br₂) sur un alcène, il faut identifier
un alcène qui possède le même squelette carboné que l’hydrocarbure de départ
(A1), le 2-méthylpropane, et qui peut donner un dérivé dibromé
isomère de (B).
Étape 1 : Trouver la formule brute du composé (B1)
L’hydrocarbure (A1) est le 2-méthylpropane : (CH₃)₂CH–CH₃, soit de formule brute C₄H₁₀.
Si on remplace deux atomes d'hydrogène par deux atomes
de brome, on obtient un dibromo-dérivé de formule
brute : C₄H₈Br₂.
Étape 2 : Rechercher un alcène correspondant
La réaction d'addition de Br₂ sur un alcène suit :
Alcène + Br₂ → dibromoalcane
On cherche donc un alcène de formule brute : C₄H₈.
Un alcène compatible est le 2-méthylpropène :
Formule semi-développée :
CH₂=C(CH₃)–CH₃
Nom : 2-méthylpropène
Formule brute : C₄H₈
Réaction :
CH₂=C(CH₃)–CH₃ + Br₂ → BrCH₂–CBr(CH₃)–CH₃ → (B1)
Conclusion :
b) L’alcène dont l’addition de Br₂ permet d’obtenir l’isomère dibromé
(B1) est :
➡ Le 2-méthylpropène
➡ Formule brute : C₄H₈
➡ Nom : 2-méthylpropène
c. Voici l'équation de la réaction d'addition du dibrome (Br₂) sur le 2-méthylpropène (C₄H₈) :
C₄H₈ + Br₂ → C₄H₈Br₂
Avec les formules semi-développées :
CH₂=C(CH₃)–CH₃ + Br₂ → CH₂Br–CH(Br)(CH₃)–CH₃
Nom du produit : 1,2-dibromo-2-méthylpropane
Il s'agit d'une addition électrophile classique sur
une double liaison C=C, le Br₂ se fixe sur les deux atomes de carbone initialement engagés dans la double
liaison.
d) Oui, la
structure de l'hydrocarbure de départ C₄H₁₀ (butane
ou isobutane) a été modifiée au cours de cette réaction
Explication :
La réaction avec le dibrome (Br₂) en présence de lumière (hv) est une réaction de substitution radicalaire.
Dans cette réaction :
- Un atome d'hydrogène de C₄H₁₀ est
remplacé par un atome de brome.
- Cela donne des composés comme C₄H₉Br
ou des dérivés di-substitués C₄H₈Br₂.
Donc :
- Le nombre d'atomes de carbone reste le même (la chaîne
carbonée n'est pas rompue).
- Mais la nature chimique de la molécule change : ce n’est plus
un alcane pur, mais un halogénoalcane.
Conclusion :
Oui, la
structure chimique de l’hydrocarbure C₄H₁₀ a été
modifiée, car un ou plusieurs atomes d'hydrogène ont été remplacés par des
atomes de brome
Avez-vous
un exercice à proposer ?Cliquez-ici
Merci de votre visite
Laissez un commentaire