ETUDE DE QUELQUES
COUPLES REDOX
Etude du couple Fe3+/Fe2+
-
Réaction entre les ions Fer (III) et le Fer métallique
Dans un tube à essai contenant quelque ml de chlorure de Fer
III (Fe3+ + 3 Cl-), de couleur Jaunâtre, ajoutons de la limaille de
Fer et agitons. La limaille de Fer disparait et la solution devient verdâtre,
preuve de formation d’ions Fe2+
|
(x 2) (Fe3+ + è " Fe2+) (x1) Fe " Fe2+ + 2è |
|
2Fe3+
+ Fe " 3Fe2+ |
Les ions Fe2+ peuvent
être mis en évidence en présence du NaOH : ils donnent un précipité vert
d’hydroxyde de Fer II : Fe(OH)2
-
Réaction entre les ions fer (II) et les ions argent
Introduisons du nitrate d’argent dans une
solution de sulfate de fer II. Il se forme un dépôt d’argent tandis que la
solution jaunit.
|
Fe2+
" Fe3+ + è Ag+ + è " Ag |
|
Fe2+ + Ag+ " Fe3+ + Ag |
Les ions Fe3+
formés peuvent être mis en évidence en présence de la soude. Ils donnent un
précipité de couleur rouille
d’hydroxyde de Fer III : Fe(OH)3.
Dans la 1ère expérience ; les
ions Fe3+ sont réduits à l’état d’ion Fe2+,
Fe3+ +e→Fe2+
Dans la 2nd, les ions Fe2+
sont oxydés en ions Fe3+
Fe2+→Fe3+ +e
Ces deux espèces forment un couple redox Fe3+/Fe2+
caractérisé par :
Fe3+ + e ⇆ Fe
2+
Son potentiel standard est mesuré à partir de la
pile formée d’une électrode de platine inattaquable plongeant dans une solution
contenant les ions Fe2+ et Fe3+, et l’électrode standard
à l’hydrogène est :
E° (Fe3+/Fe2+)
= 0,77V
Le couple Cl2/Cl-
Dans l’expérience
précédente, remplaçons le nitrate d’argent par l’eau de chlore. On constate que
les ions Fe2+ sont également oxydés en ions Fe3+ et le
dichlore, dans le même temps a été réduit à l’état d’ions Cl- .
Les demi-équations électroniques
s’écrivent :
(x2) Fe2+ →Fe3+ + è
(x1) Cl2 +2è →2Cl-
Et l’équation-bilan :
2Fe2+ + Cl2 →2Fe3+ + 2Cl-
On sait par ailleurs qu’au cours de certaines
électrolyses, les ions Cl- sont oxydés à l’état de dichlore :
2Cl-
→ Cl2 +2è
On met donc en évidence le couple Cl2/Cl-
dont l’équation s’écrit ;
Cl2 + 2è ⇆ 2Cl-
Le potentiel standard de ce couple est :
E° (Cl2/Cl-)
= 1,39V
Le dichlore Cl2 est un gaz
jaune-vert ; les solutions d’ions chlorure Cl- sont incolores.
Tout comme le diïode , le dichlore est un oxydant.
Le couple I2/I-
Dans les conditions
normales de température et de pression (CNTP), le diïode est un solide. Ses
solutions aqueuses sont brunes. Les solutions d’ions iodures sont incolores.
Dans un tube à essai contenant quelques
millilitres d’iodure de potassium incolore, introduisons une solution de
chlorure de Fer (Fe3+ + 3Cl-) Le contenu du tube prend une couleur
brune caractéristique du diiode.
Les ions iodures ont été oxydés à l’état du
diiode :
2I- → I2 +2è
Tandis
que les ions Fe3+ ont été réduits à l’état d’ions Fe2+ :
Fe2+
→Fe3+ + 2è
L’équation-bilan
s’écrit :
2I- + Fe2+ " I2 +Fe3+
On
sait par ailleurs que le diiode peut
être réduit à l’état d’ions I- :
I2 + 2è
→ 2I-
. En présence d’une solution de diïode, la
limaille de Fer s’oxyde en ions Fe2+. Il se forme en même temps les
ions iodures I-. L’oxydant est le diïode I2, son réducteur conjugué
est l’ion iodure.
Le couple I2/I- ainsi
formé a pour demi-équation électronique.
I2 +
2è ⇆ 2I-
E°
(I2/I-) = 0,62V
Le couple Mn O-4/Mn++
Dans un tube à essais
contenant une solution de sulfate de fer II et quelques gouttes de H2SO4,
ajoutons quelques ml d’une solution violette de permanganate de potassium et
observons : le permanganate de potassium se décolore.
L’analyse de la solution obtenue … qu’elle
contient des ions Mn2+ et Fe3+
Les ions Fe3+ proviennent de
l’oxydation des ions Fe2+ selon la demi-équation : Fe2+ "Fe3+ + è les
ions Mn O-4 sont réduits en ions Mn++
(incolores en solution).
Dans d’autres conditions, les ions Mn+2
sont oxydés en ions Mn O-4. Les ions MnO-4 et
Mn2+ forment un couple noté MnO-4/Mn2+
MnO-4 → Mn2+
MnO-4
→ Mn++ + 4H2O
MnO-4 + 8H3O+→Mn2+ + 12H2O
MnO-4 + 8H3O+ + 5è ⇆ Mn2+
+ 12H2O
Bilan:
MnO-4 + 8H3O+
+ 5Fe2+ → Mn2++12H2O+5Fe3+
Le couple NO-3/NO
Ajoutons de l’acide
nitrique (H3O++NO-3) sur de la
tournure du cuivre. On observe un
dégagement de vapeurs rousses et la solution devient bleue. Il s’est formé des
ions Cu2+ et de mono oxyde d’azote NO au contact du dioxygène de
l’air, le NO (gaz incolore) donne du dioxyde d’azote NO2 (gaz de
couleur rousse).
Cu→Cu2+
+2e
L’ion H3O+ n’est pas un
oxydant assez fort pour attaquer le cuivre métallique. C’est donc l’ion nitrate
NO-3 qui est responsable de l’oxydation. Son réducteur
conjugué est le mono oxyde d’azote :
NO-3 +….→ NO + …..
NO-3 +4H+ +….→
NO + 2H2O +…..
NO-3 +4H+ +3e → NO + 2H2O
NO-3 + 4H3O+
+ 3è+ ⇆ NO + 6H2O
Equation bilan :
2NO-3 +8H3O++3Cu
→2 NO+12H2O+3Cu2+
Le couple Cr2O7--/Cr3+
Versons progressivement une solution de
dichromate de potassium dans une solution de sulfate de Fer II acidifiée par
quelques gouttes d’acide sulfurique concentré. Au contact de la solution de
sulfate de fer II, la couleur jaune –orangé des ions dichromates disparait et
la solution prend la teinte verte caractéristiques des ions chrome III.
Les
ions Fe2+ ont été oxydés en Fe3+
Fe2+
" Fe3+ + è
Les
ions dichromates jaune-orangé ont été réduits à l’état d’ion chrome II, vert.
Etablissons la demi-équation
Cr2O7--
→ 2Cr3+
Cr2O7--
+ H3O+→ 2Cr3+ + H2O
Cr2O7--
+ 14H3O+ →2Cr3+ + 21H2O
Cr2O7-- + 14H3O+
+ 6è→ 2Cr3+ + 21H2O
Bilan:
Cr2O7--
+ 14H3O+ + 6Fe→
2Cr3+ + 21H2O+6Fe3+
Le couple SO42-/SO2
Lorsqu’on chauffe un tube contenant la fourrure
de cuivre et de H2SO4 concentré. Un gaz se dégage, qui
décolore un papier imbibé de permanganate de Potassium : c’est le dioxyde
de soufre : SO2.
SO2 provient de la réduction des
ions sulfates
SO2-4 +………. →SO2 + ……….. Conservation des éléments
SO2-4 + 4H3O+ →SO2 + 2H2O
Conservation des charges
SO2-4 + 4H3O+
+ 2è →SO2 + 6H2O
Les ions sulfates réduisent le cuivre à l’état
Cu2+
Cu →Cu2+ + 2è
![]() Equation Bilan:
Equation Bilan:
SO2-4 + 4H3O+
+ Cu →SO2 + 6H2O + Cu2+
L’acide sulfurique est
un acide à anion oxydant lorsqu’il est concentré et chaud.
![]() Dans certains ions, il est possible de transformer le
dioxyde de soufre en ion sulfate.
Dans certains ions, il est possible de transformer le
dioxyde de soufre en ion sulfate.
SO2-4 + 4H3O+
+ 2è ⇆ SO2 + 6H2O
E°(SO2-4/SO2) = 0,17
V
NB: H2SO4
n’attaque pas le Cu à froid
Le couple S4O2-6/S2O32-
Versons une solution de diiode (le diiode étant
peu soluble dans l’eau, le solvant utilisé est l’iodure de Potassium. Dans un
verre contenant du thiosulfate de Sodium (2Na+ + S2O32-)
au contact du thiosulfate de Sodium, la couleur brune du diiode disparaît
immédiatement.
Le diiode est réduit à l’état d’ion iodures I- :
I2 + 2è →2I-
L’ion thiosulfate est
oxydé à l’état d’ions tetrathionate S4O2-6.
2S2O2-2 →S4O2-6
+ 2è
Equation bilan :
2S2O2-3
+ I2 →S4O2-6 + 2I-
Il
est possible de réduire l’ion tetrathionate à l’état d’ions thiosulfates
![]() 2S2O2-3 + S4O2-6 + 2è
2S2O2-3 + S4O2-6 + 2è
E°(S4O2-6/S2O32-)
= 0,09 V
EXERCICES
EXERCICE I :
a)
Quelle est l’équation de la réaction entre l’acide nitrique et le cuivre,
sachant qu’elle donne naissance au monoxyde d’azote ?
Quelle
est l’espèce oxydante ?
Quelle
est l’espèce réductrice ?
b)
lorsqu’on plonge une tournure de cuivre dans une solution aqueuse de nitrate de
sodium (NaNO). L’on observe aucun dégagement de monoxyde d’azote. Expliquez
pourquoi.
EXERCICE II:
A l’aide d’un dispositif, on recueille le 8 cm3
de monoxyde de d’azote NO formée par action de l’acide nitrique sur du cuivre.
1-Ecrire les demi-équations électroniques et
l’équation bilan.
2-Calculer la masse du cuivre qui a réagi, sachant
que le volume gazeux a été mesure dans les C.N.T.P.
EXERCICE III:
Un
antiseptique est une substance qui, par oxydation, prévient l’infection des
tissus vivants en éliminant les microorganismes ou en inactivant les virus. Une
solution de permanganate de potassium (K+ + Mno-4)
est utilisée comme antiseptique. L’ion permanganate MnO-4 (constituant
actif) est un oxydant en milieu acide.
1-Définir :
oxydation, oxydant.
2-Les ions
permanganates MnO-4 d’une solution acidifiée de
permanganate de potassium, réagissent avec les ions chlorures Cl-
d’une solution d’acide chlorhydrique pour donner un dégagement de dichlore Cl2
et des ions permanganates Mn2+ en solution.
2.1- Ecrire les couples
Ox/Red mis en jeu et les classer.
2.2- Ecrire les
demi-équations d’oxydoréduction correspondantes.
2.3- En déduire
l’équation-bilan équilibrée de la réaction.
3- On dispose d’une solution aqueuse de
permanganate de potassium à 0,5 mol.l-1. En applications répétées,
cette solution est irritante. On se propose de la diluer pour obtenir 1 l de
solution de concentration 2.10-2 mol.l-1.
3.1-Quel volume de solution initiale
doit-on prélever ?
3.2-Indiquer une précaution à
prendre pendant l’utilisation de permanganate de potassium non dilué.
EXERCICE IV :
On dissout 10g de sulfate de Fer III (Fe2(SO4)3)
dans 100 ml d’eau.
1-Calculer la concentration des ions Fe3+
et en ion a SO2-4 de la solution.
2-On introduit de la limaille de Fer en excès.
Montrer que le Fer est oxyde. Ecrire l’équation bilan de la réaction.
3-Determiner les variations de la masse de Fer
métallique lorsque tous les ions Fe3+ ont été réduits.
4-Calculer la concentration en ion Fe2+
CORRIGES
EXERCICE I :
a)
(x3) Cu→Cu2+ +2e
(x2) NO-3 + 4H3O+
+ 3è+ ⇆ NO + 6H2O
3Cu+2NO-3 +8H3O+
⇆3Cu2+
+2 NO+12 H2O
Espece
oxydante: NO-3
Espece reductrice: Cu
b) ll y a absence d’ions H3O+ dans la
solution.
EXERCICE II:
1-
(x3) Cu→Cu2+
+2e
(x2) NO-3 + 4H3O+
+ 3è+ ⇆ NO + 6H2O
3Cu+2NO-3 +8H3O+
⇆3Cu2+
+2 NO+12 H2O
2- masse du cuivre
![]()
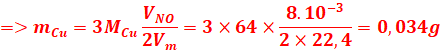
EXERCICE III:
1-
2-
2.1- MnO-4 /Mn2+ et Cl2/Cl-
2.2-
2Cl- →
Cl2 +2è
MnO-4 + 8H3O+ + 5è ⇆ Mn2++ 12H2O
2.3- équation-bilan
équilibrée de la réaction.
10Cl- +2MnO-4 + 16H3O+ ⇆ 5Cl2+2 Mn2+ + 24H2O
3-
3.1- ViCi=VfCf=>Vi= VfCf/Ci=1x2.10-2/0,5=0,02
l
3.2- Porter des gants et des lunettes de protection.
EXERCICE IV :
1-Concentration des ions Fe3+
et en ion a SO2-4 de la solution.
M=2x56+3(32+4x16)=400
n=10/400=0,025
c=n/V=0,025/0,1=0,25
mol/l
Fe2(SO4)3 → 2Fe2+ + 3SO2-4
![]()
![]()
![]()
![]()
2-’équation bilan de la réaction.
2Fe3+ + Fe → 3Fe2+
3-variations de la masse de Fer métallique
lorsque tous les ions Fe2+ ont été réduits.
![]()
![]()
4-Calcul de la concentration en ion Fe2+
Les ions Fe2+sont issus de la réduction des ions ![]() :
: ![]()
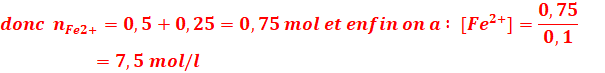
Avez-vous
un exercice à proposer ? Cliquez-ici
Merci de votre visite
Laissez un commentaire