APPLICATIONS
AUX DOSAGES
DEFINITION
Un
dosage est une technique expérimentale qui permet de déterminer la concentration
molaire C inconnue d’une espèce chimique dans une solution.
De façon générale, on fait réagir une espèce chimique A, de concentration CA
inconnue sur une espèce chimique B de concentration CB connue, selon
la réaction chimique :
A + B → D
Cette réaction chimique entre A et B doit être unique, rapide et totale.
On parle aussi de titrage.
Il existe
plusieurs types de dosages acido-basiques : parmi lesquels :
▪ Le dosage pH-métrique : le titrage s’effectue à l’aide d’un pH-mètre
pour mesurer le pH de la solution pendant l’aout de la solution titrante. Le
changement de pH permet de déterminer avec précision le point d’équivalence.
▪ Le dosage colorimétrique : Ce dosage repose sur l’utilisation d’un
indicateur coloré qui change de couleur en fonction du pH de la solution.
L’indicateur est choisi en fonction de la variation de couleur qu’il présente à
proximité du point d’équivalence.
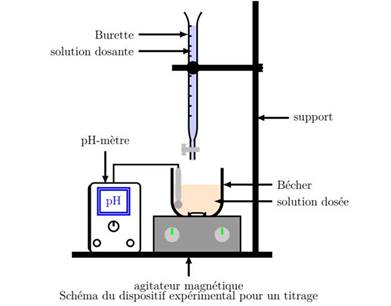
DISPOSITIF EXPERIMENTAL
On utilise :
-une burette graduée dans laquelle il y a la solution titrée,
-un bécher dans lequel il y a la solution a
titrer + quelques gouttes d’IC,
-un pH-mètre pour suivre l’évolution du pH
-un agitateur magnétique pour homogénéiser le mélange.
EXEMPLES
DE REACTIONS ACIDO-BASIQUES
Ainsi, on peut utiliser les réactions acido-basiques suivantes :
Dosage acide fort – base
forte
Équation de réaction :
H3O+ + OH-→ 2 H2O
-Le
pH à l’équivalence est 7,0 à 25°C
La courbe du titrage :
Lors du titrage
pH-métrique, on mesure le pH à l’équilibre après chaque ajout du réactif
titrant. Ensuite on trace la courbe représentant les variations du pH en
fonction du volume versé Vb de la
solution titrante, cette courbe est appelée : courbe du titrage (en
rouge).
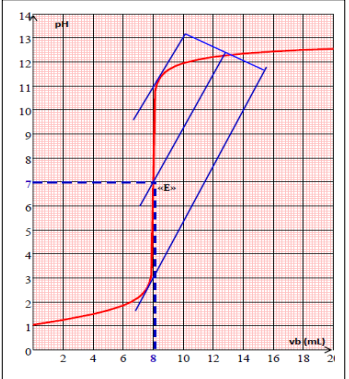

 .
.
-Au voisinage de 8 ml, on note une brusque augmentation du pH appelée saut de pH. Ce saut de pH au cours
duquel la courbe change de concavité traduit le fait que les ions HO- jusque-là
minoritaires, deviennent majoritaires. En outre, il contient un point
particulier qui est un point
d’inflexion.
- L’équivalence est obtenue lorsque les réactifs sont mélangés dans des
proportions stœchiométriques : dans ce cas, la quantité d’ions HO-
versée est égale à la quantité d’ions H3O+ contenus initialement
dans le bécher.
On a donc la relation :
n H3O+(init) =n HO-(init). =>CaVa=CbVbE
VbE est le volume équivalent
Le point appartenant à
la courbe correspondant à l’équivalence est appelé : point d’équivalence,
il est caractérisé par ses coordonnées (VBE;
pHE),
Indicateur :
Un indicateur coloré de pH est souvent
utilisé pour repérer le point d’équivalence, c.-à-d. le moment ou la
neutralisation est complète.
Exemple :
Le bleu de bromothymol ( BBT ) dont la zone de
virage est de 6 a 7,6 contient ce pH.
DOSAGE ACIDE FAIBLE – BASE FORTE
Équation de réaction
AH + OH-→ A- + H2O
-C’est une réaction exothermique
-Le pH à l’équivalence est basique (pH>7)
-c’est une réaction quasi-totale.
Courbe du titrage


![]()
-On note un saut de pH moins important
-Le pH à l’équivalence est supérieur à 7. En effet, à l’équivalence, la
solution est basique (de la même manière le pH
à l’équivalence lors du dosage d’une base partiellement dissociée par un acide
totalement dissocié est inférieur à 7).
-La courbe admet deux points d’inflexion.
En effet, la courbe de dosage comporte un point d’inflexion supplémentaire,
en dehors du point équivalence. Il s’agit du point de demi-équivalence
-A la
demi-équivalence E1/2, ( Vversé = Véquivalence / 2 ) ou Vb=VBE/2
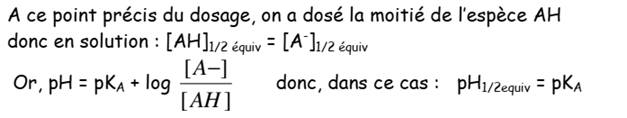
Indicateur :
Lors du dosage entre un acide faible et une base
forte, l’équivalence acido-basique peut être déterminée avec un des indicateurs
colorés tels que le bleu de bromothymol et la phénolphtaléine.
Dosage acide fort – base
faible
Équation de réaction
H3O+ + A-→ AH + H2O
-Le pH à l’équivalence est acide (pH<7)
-réaction exothermique
Courbe du titrage


![]()
- la courbe de dosage comporte un point d’inflexion supplémentaire, en dehors
du point équivalence. Il s’agit du point de demi-équivalence (ou Vversé = Véquivalence
/ 2 ).
- A la demi-équivalence E1/2, le pH est
égal au pKA du couple contenant l’acide
faible :
pH1/2=pKA
Indicateur :
Lors du dosage entre un acide fort et une base faible,
l’équivalence acido-basique peut être déterminée avec un des indicateurs
colorés tels que le rouge de chlorophénol.
DETERMINATION
GRAPHIQUE DU POINT D’EQUIVALENCE
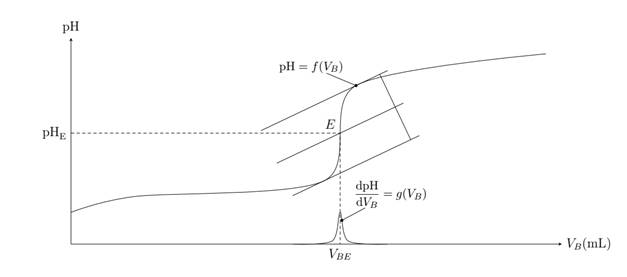
.Méthode
des tangentes
Le point d’équivalence
peut être repéré par une méthode graphique, c’est la méthode des tangentes :
On trace deux tangentes à la courbe du titrage, parallèles et situées de part
et d’autre du saut du pH, puis on trace la droite parallèle aux deux tangentes
et située à égale distance, le point d’intersection de la courbe de titrage
avec cette droite est le point E d’équivalence.
.Méthode
de la courbe dérivée
Une autre méthode est
utilisée pour repérer le point d’équivalence, c’est la méthode de la courbe
dérivée : On trace la fonction g(VB) = dpH
/dVB , le volume d’équivalence est l’abscisse du maximum
de cette courbe.
EXERCICES
EXERCICE I :
On dispose d’une solution d’acide méthanoïque HCOOH
de concentration CA=0,10 mol/l et de pH=2,4 à 25 C.
1.Ecrire l’équation-bilan de la réaction de cet
acide avec l’eau.
2. On verse un volume VA=20 ml de cette
solution dans un bécher, puis on y ajoute un volume VB de solution
d’hydroxyde de sodium de concentration CB=0,25 mol/l
2.1-Ecrire l’équation-bilan de la réaction qui se
produit.
2.2-Determiner le volume VBE de la
solution d’hydroxyde de sodium a l’équivalence.
2.3-A l’équivalence, le pH de la solution est 8,3.
justifier simplement le caractère basique de la solution.
2.4-Quel IC est conseillé pour ce dosage ?
2.5-En tenant compte des points remarquables
rencontrés précédemment, et sachant que pour VB=VBE/2, le
pH est 3,8, tracer l’allure de la courbe de dosage pH=f(VB)
EXERCICE II :
On dose par pH-métrie 20 mL
d'une solution d'un acide HA de concentration initiale inconnue, par une
solution d'hydroxyde de sodium 0,1 mol·L-1 . On
obtient les résultats suivants :

a) Tracez la courbe de variation du pH en fonction
du volume de base.
b) Déterminez le point d'équivalence et la
concentration initiale de l'acide.
c) Quel est le pKa de cet
acide ?
EXERCICE III:
1- Au cours d’une séance de Travaux pratiques,
on fait réagir entre elles deux solutions aqueuses, l’une de monoéthylamine C2H5NH2, l’autre d’acide
chlorhydrique, afin déterminer la constante pKA
du couple acide-base
C2H5NH3+/C2H5NH2
L’acide chlorhydrique a
une concentration Ca = 10-1 mol.l-1. On verse progressivement l’une des
solutions dans V=10cm3 de l’autre et on mesure les différentes
valeurs prises par le pH en fonction du volume versé.
Deux
groupes d’élèves comparent les tracés (courbes n°I et
n° II) qu’ils ont obtenus et constatent qu’ils n’ont pas suivi le même nombre
opératoire.
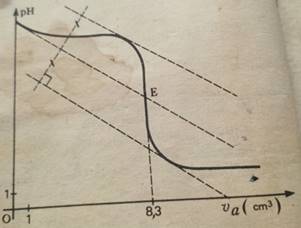 courbe I
courbe I
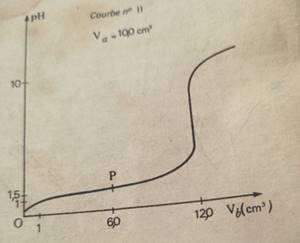 courbe II
courbe II
1°
a) Ecrire l’équation bilan de la réaction acide-base.
b) Calculer et comparer les valeurs de la
concentration molaire Cb de la solution de monoéthylamine
déduites de l’étude des deux courbes.
2°
A partir de la courbe I, déterminer en justifiant votre réponse, la valeur de
la constante pKA du couple acide-base C2H5NH3+/C2H5NH2
EXERCICE IV:
L'amicale
des anciens élèves du collège Bilingue "LES COMPETENTS" a fait un don
en matériel de chimie à leur ancien établissement. Parmi ce matériel se trouve
un pH mètre.
Nécessitant le mode de fabrication d'une solution de pH connu qui servira de
vérifier le bon fonctionnement de l'appareil avant son utilisation, le
principal du collège adresse à l'établissement le plus proche la commande
suivante :
« Besoin urgent d’un protocole pour fabrication de 150 mL
d’une solution tampon de pH- 9,2 afin de vérifier le bon fonctionnement de
notre pH- mètre nouvellement offert par notre chère amicale »
ATEBA élève de terminale D. est intéressé par la préoccupation du principal.
Pour cela il se rend au laboratoire du Lycée et se met à l'œuvre.
Les solutions (avec leur concentration), la verrerie et le matériel disponibles
au laboratoire sont consignés dans le tableau suivant :
Solutions
• Acide chlorhydrique : C1=0,1 moL/L
• Hydroxyde de sodium : C1=5×10−2 moL/L
• Ammoniac : C3=0,1 moL/L
• Acide éthanoïque : C4=5×10−2 moL/L
• Eau distillée
Verrerie et matériel
• Burettes
• Erlenmeyers
• Béchers
• pH-mètre
• Agitateurs magnétiques
• Potences
• Barreaux aimantés
• Pissettes d'eau
Données : pKa(CH3COOH/ CH3COO−)=4,8 et pKa(NH+4/ NH3)=9,2
1. Propose un protocole qui permet d'aboutir au point de demi-équivalence en
utilisant un acide faible AH, une base forte HO− et un
pli-mètre. 8 pts
Tu t'aideras d ‘un dispositif expérimental.
2. A partir d'un choix judicieux des réactifs parmi ceux disponibles au
laboratoire, réponds au besoin de la commande tout en précisant les volumes à
utiliser. 8 pts baccalauréat C, D et E 2021
EXERCICE V:
Des sachets
d'aspirine en poudre portant tous l'étiquette « aspirine 100 mg » ont été
livrés à un établissement scolaire. Malheureusement le nombre reçu est en deçà
de celui attendu.
Soucieux et enthousiastes, deux élèves Eric et
Viviane de cet établissement se proposent des défis suivants :
Défi de Eric : synthétiser 100 g d’aspirine.
Défi de Viviane : vérifier la masse effective d’aspirine dans un sachet de la
livraison.
Opérations
effectuées par Eric :
Dans un erlenmeyer, bien sec, sous hotte, il introduit :
• m1 = 80 g d’a¢ide sa1i¢y1ique;
• V2 = 100 mL d’anhydride éthanoïque ;
• Quelques grains de pierre ponce.
Il adapte un réfrigérant à air sur l’erlenmeyer ;
Il se produit une réaction chimique aboutissant à l’aspirine avec un rendement
évalué à 85 %.
Opérations
effectuées par Viviane :
Elle prépare une solution S en introduisant tout le contenu d’aspirine d’un
sachet (100 mg) dans une fiole jaugée, puis y ajoute de l’eau distillée pour
obtenir une solution de volume 500 mL.
Elle dose un volume VA = 100 mL de cette
solution S par une solution aqueuse solution S par une solution aqueuse
d’hydroxyde de sodium (Na++HO−) concentration molaire CB=10−2 moL/L en présence d’un indicateur coloré approprié.
Le volume de base obtenu à l’équivalence est VBE=11,1 mL.
Equation-bilan
de synthèse de l’aspirine
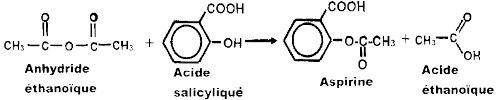
En utilisant
les informations ci-dessus et en effectuant obligatoirement des calculs,
1- Examine si Eric a relevé son défi ou non.
2- Exploite les résultats des travaux de Viviane et prononce-toi sur la masse
d’aspirine (100 mg) inscrite sur l’étiquette d’un sachet. 8pts
On donne : Masse volumique de l'anhydride éthanoïque. ρ=1080g.L−1
Masses molaires en g/mol: aspirine :180 ; acide
salicylique : 138 ; anhydride éthanoïque : 102
EXERCICE VI:
Maman NTOLO a
acheté au marché une bouteille de vinaigre pour assaisonner ses salades. Sur
l’étiquette de la bouteille est écrit l’indication : degré du vinaigre
: d=8o
Son fils ainé, élève en classe de Terminale D se propose d’analyser ce vinaigre
afin de vérifier son degré d.
Pour cela, il dose un volume VA=20mL de solution de ce vinaigre par
une solution molaire (CB=1mol.L−1) dihydroxyde de sodium (Na++HO−).
Les résultats obtenus lors du dosage ont permis le trace
du pH en fonction du volume de base
VB versé. (voir figure ci-dessous).
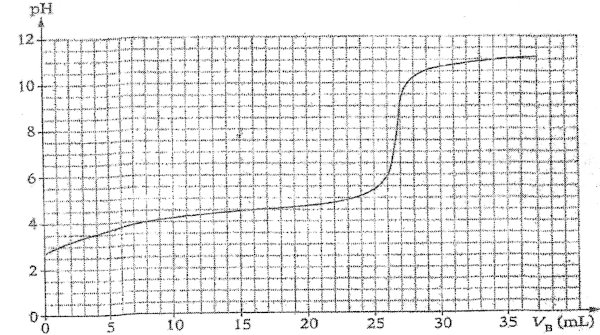 Information
1 : Le vinaigre acheté contient l’acide éthanoïque de formule CH3COOH.
Information
1 : Le vinaigre acheté contient l’acide éthanoïque de formule CH3COOH.
Information 2 : Le degré d du vinaigre est le pourcentage massique
d’acide éthanoïque contenu dans le vinaigre et s’exprime par la relation
: d=6CA avec CA, la concentration en acide éthanoïque (en moL/L) de la solution du vinaigre.
A partir des informations ci-dessus et à l’aide d’un raisonnement logique,
1 - Propose, schéma à l’appui, un protocole expérimental permettant d’obtenir
les mesures qui ont permis de tracer la courbe pH=f(VB) .
2 -Vérifie si l’indication ( 8° ) portée sur
l’étiquette de la bouteille est conforme.
Support : courbe pH=f(VB) obtenue lors du dosage réalisé : baccalauréat C, D et E 2024
CORRIGES
EXERCICE
II :
1.
HCOOH+H2O→HCOO- + H3O+
2.
2.1-
HCOOH +HO- →HCOO- +H2O
2.2-A l’équivalence, nA=nB < =>CAVA=CBVBE
=>VBE=CAVA/CB=0,1x20/0,25=8
ml.
2.3-Les ions HCOO- sont majoritaires or
HCOO- est la base conjuguée de HCOOH => solution basique
2.4-Le BBT et l’hélianthine est conseillé
pour un dosage acide faible-base forte.
2.5-
EXERCICE
II :
a)
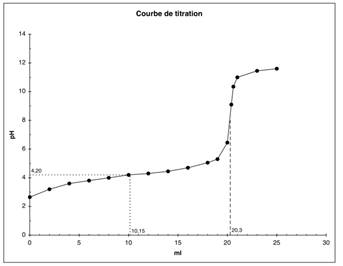
b)
Le point d'équivalence est déterminé graphiquement : Véq
= 20,3 mL.
On
calcule ensuite la concentration de l'acide avec la formule CA ⋅
VA = CB⋅ VB : => CA = CB⋅
VB /VA = 0,1⋅ 0,0203 /0,020 = 0,1015 mol⋅ L−1
c)
A la demi-titration, on a pH = pKa. La lecture
graphique donne pKa = 4,2.
EXERCICE III :
1° a)
C2H3NH2 +H3O+ → C2H3NH3+ + H2O
b)
A l’équivalence, la réaction ci-dessus est terminée : on
constate depuis la traduction de l’équation, qu’on a utilisé le même nombre nb
moles de molécules C2H3NH2 et de moles na
d’ions H3O+.
CaVaE = CbVb pour l’expérience I.
CaVa = CbVbE pour l’expérience II.
Par la méthode des tangentes, on trouve le point E représentant
l’équivalence :
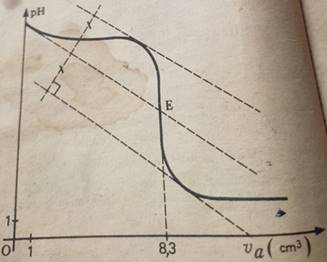
Expérience I: On verse progressivement la
solution basique dans Va=10cm3 de solution acide. D’après la courbe
I, l’équivalence est atteinte pour VbE=10 cm’
VaE=8,3 cm3 ;
Ca=10-1mol/l ;Vb=10cm3
CbI=CaVaE/Vb=10-1x8,3/10=8,3.10-2
mol/l
Expérience II : On verse progressivement la solution acide dans
Vb=10cm3 de solution basique. D’après la courbe
II, l’équivalence est atteinte pour VaE=8,3 cm’
VaE=10 cm3 ; Ca=10-1
mol/l; VbE=12 cm3
CbII=CaVa/VbE=10-1x10/12=8,33.10-2mol/l
On constate que ces valeurs sont égales a moins de 2% près, ce qui
est compatible avec les difficultés d’appréciation des volumes.
2°
Entre le pH d’une solution de monoéthylamine
et le pKa du couple, il existe la relation :
pH=pKA + ![]()
Quand [C2H5NH2]=[
C2H5NH3+].ce
qui est le cas à la demi-équivalence, pH=pKA
Courbe I
=>a la demi-équivalence Va=VbE/2
donc Va=4,15 cm3 et
on lit le pH correspondant 10,8
ð
pKA=10,8 pour le couple C2H5NH3+/C2H5NH2
EXERCICE IV:
1-
Protocole permettant d’aboutir au point de demi-équivalence
Dosage pH-métrique d'une solution d'acide faible All par une base
l'une HO−
♦ Après avoir rincé la verrerie,
♦ Introduire un volume Va de la solution d'acide faible dans un bûcher ;
♦Introduire la solution de base forte dans la burette graduée jusqu'à la
graduation zéro (0);
♦Plonger les électrodes du pH-mètre préalablement étalonné dans le
bécher:
♦ Mettre en marche l’agitateur magnétique ;
♦ Verser progressivement la solution de base forte dans le bécher ;
♦ Noter chaque fois la valeur du pH indiquée par le pH-mètre
correspondant au volume de base versé ;
A l'aide des résultats obtenus, tracer la courbe pH=f(Vb) ;
♦ Déterminer le volume à l'équivalence VbE;
par la méthode des tangentes parallèles ;
♦ Calculer le volume a la demi-équivalence Vb(12eq)=Vbeq2 de
base à verser
♦ Reprendre le dosage en laissant couler un volume Vbeq2 de la
solution de base forte dans le bécher contenant le volume Va initial de la
solution d'acide faible et lire le pH correspondant au mélange obtenu.
Dispositif expérimental.
 2- Le problème posé :
Préparation d'une solution tampon de pH=9,2
2- Le problème posé :
Préparation d'une solution tampon de pH=9,2
pH=pKa+ log[NH3][NH+4] =9,2= pKa(NH+4/NH3)
1| faut que [NH+4]=[NH3] pour
avoir pH=pKa.
N'ayant pas les ions NH+4 en solution, il faut
les produire en faisant réagir NH3 avec H3O+.
Suivant l'équation de la réaction :
NH3+H3O+ →NH+4+ H2O
Réactif à choisir : Ammoniac et acide chlorhydrique.
Il faut doser l’ammoniac par l'acide chlorhydrique jusqu'à la demi-
équivalence 1,5 pt
Calcul des volumes l'acide et de base à prélever
ð
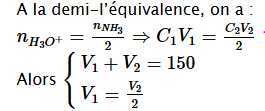
Car, ces solutions ont une même concentration
On trouve V1=50 mL et V2=100 mL 1
Pour répondre au besoin de la commande, ATEBA doit :
Réaliser dans un bécher un mélange 50 mL de solution
d’acide chlorhydrique et 100 mL de solution
d'ammoniac.
Ou bien il doit introduire 100 mL de solution
d’ammoniac dans un bécher puis à l’aide d'une burette laisser couler 50 mL de solution d'acide chlorhydrique.
Le mode de préparation de la solution tampon commandé peut être acheminé au
principal du collège Bilingue les COMPÉTENTS
EXERCICE VI:
Examinons
si Eric a relevé son défi. Pour cela on va :
• Déterminer le réactif limitant
• Exploiter l'équation bilan de la réaction ;
• Déterminer la masse d'aspirine synthétisé ;
• Comparer à la masse escomptée
• Conclure
1) Détermination du réactif limitant
soit nas la quantité de matière de l’aspirine
et nac, celle de l’anhydride éthanoïque.
![]()
![]()
![]()
Déterminons
la masse d’aspirine synthétisée
Soit :
m3(obt) la masse d’aspirine obtenue et m3(att)
celle d’aspirine attendue théoriquement.
m1 la masse d’acide salicylique et M1 la masse molaire
d’acide salicylique
D’après
l’équation-bilan :
![]()
Conclusion
: 88,7g≺100g donc Erie n'a pas relevé son défi.
2
: Vérification de la masse d'aspirine sur l'étiquette.
Démarche
:
• Écrire la relation à l'équivalence
• Déterminer ln concentration Ca de
la solution d’aspirine ;
• Déterminer la masse d'aspirine contenu dans la solution préparée ;
• Comparer à la masse de l'étiquette puis conclure.
Relation à l'équivalence
Il s'agit du dosage de l'aspirine contenant une fonction acide carboxylique par
une monobase forte (hydroxyde de sodium)
Équation bilan de la réaction du dosage :

Détermination
de la concentration Ca de la solution d’aspirine
![]()
CA=11x10-3 mol/l
Détermination
de la masse d’aspirine contenue dans la solution préparée (V=500 ml)
![]()
Conclusion
: La masse sur le sachet d’aspirine est conforme
EXERCICES VII :
I.
Protocole :
• Introduire un volume VB = 20 mL
de la solution de vinaigre dans un bécher :
• Introduire la solution d’hydroxyde de sodium dans la burette
• Plonger les électrodes de pH-mètre préalablement étalonné dans le bécher
• Mettre en marche l’agitateur magnétique;
• Verser progressivement la solution de base forte dans le bécher ;
• Noter chaque fois la valeur du pH indiquée par le pH-mètre correspondant au
volume de base versé et cela permettra de tracer la courbe pH=f(VB).
• Schéma du dispositif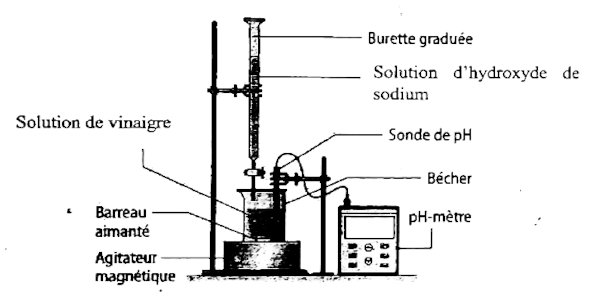
2-
Vérification de la conformité du degré du vinaigre.
Actions à mener :
Écrire l’équation-bilan support du dosage ;
Déterminer graphiquement VBE ;
Déterminer la concentration d`acide contenu dans l’échantillon dosé ;
En déduire le degré du vinaigre ou pourcentage massique d`acide éthanoïque ;
Comparer à celui porté sur l’étiquette
Conclure.
Résolution
CH3−COOH+OH− →CH3−COO−+H2O
Graphiquement on trouve VBE=26,8mL
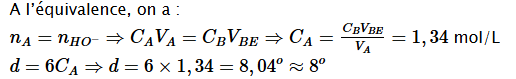
Conclusion : L’indication portée sur l’étiquette est conforme.
Avez-vous
un exercice à proposer ? Cliquez-ici
Merci de votre visite
Laissez un commentaire