LES TRANSFORMATIONS CHIMIQUES
Définitions
Une transformation chimique est un phénomène au cours duquel des
substances réagissent ensemble pour donner des nouvelles substances. Ce qu’on
appelle précisément une réaction chimique.
Ø Au cours d’une
transformation chimique,
-lorsqu’il y a
dégagement de chaleur, elle est exothermique.
-lorsqu’il y a
consommation de chaleur, elle est endothermique.
-lorsqu’il n’y a
pas de variation de température, elle est athermique.
Ø Au cours d’une
transformation chimiques certains corps disparaissent ; ce sont de réactifs et des nouveaux
corps apparaissent : ce sont des produits.
NB : Ce n’est pas
une transformation physique (où la nature de la matière ne change pas, comme
fondre de la glace).
Exemples de réactions
chimiques : les combustions
Définitions
La combustion est une réaction chimique entre un
comburant et un combustible. Elle produit de l’énergie (chaleur et lumière) :
les réactions de combustion sont exothermiques.
Combustible- Comburant
·
Un combustible est toute
substance qui peut bruler en présence d’un comburant.
Exemple : pétrole, bois,
gaz
·
. Un comburant est une substance
qui permet la combustion d’un combustible.
Exemple : Le dioxygène
de l’air (O₂) est le comburant le plus fréquent. Sans lui,
la plupart des combustions ne peuvent pas avoir lieu.
Combustions
complètes - combustions incomplètes
·
Une combustion complète produit le dioxyde de carbone et de l’eau et se
manifeste par une flamme bleue.
Exemple :la combustion du butane sur un réchaud à gaz
bien réglé donne une flamme bleue.
·
Une combustion incomplète produit le dioxyde de carbone, de l’eau et se
manifeste par une flamme
jaune.
Exemple :la combustion
du charbon de bois noircit les fonds des marmites : il y a dépôt de
carbone (fumée noire).
Combustions
vives - combustions lentes
·
Les combustions vives sont rapides, avec flamme et chaleur.
Exemples : brulage de
papier ou de plastique.
·
Les
combustions lentes sont sans flammes, souvent invisibles.
Exemples : oxydation du
fer (formation de la rouille).
Combustion de la
bougie
Expérience
Laissons bruler
une bougie a l’air libre.

Ensuite,
introduisons une bougie allumée dans un bocal en verre fermé.

Observations et interprétations :
a-A l’air libre,
la bougie brule jusqu’à la disparition de la mèche alors que dans le bocal
rempli d’air, la bougie s’éteint spontanément au bout de 20s. La bougie a
besoin de l’oxygène de l’air pour bruler, c’est le comburant.
b- Lorsqu’on approche la main, on sent de la chaleur. La combustion de
la bougie est
exothermique.
c-Pendant la combustion de la bougie, on observe de la buée sur la paroi
du bocal en verre. La combustion de la bougie produit de l’eau.
d-Pendant la combustion de la bougie, on observe de la fumée. Lors de la
combustion de la bougie, il y a un dépôt de carbone, donc de combustion est
incomplète.
e- La vapeur issue de la combustion d’une bougie trouble l’eau de chaux.
Le combustible est constitué de la cire et de la mèche.
Conclusion
La combustion de la bougie est une transformation chimique au cours de
laquelle la bougie réagit avec le dioxygène pour donner du dioxyde de carbone,
de l’eau et du carbone.
Réactifs : bougie,
dioxygène
Produits : dioxyde de
carbone, eau et carbone.
Réaction chimique :
Bougie
+dioxygène → dioxyde de carbone+ eau + carbone
Il y a dépôt de
carbone, donc la combustion de la bougie est incomplète.
Il y dégagement de la chaleur, donc la
combustion de la bougie est
exothermique.
Test du dioxyde de carbone formé : le dioxyde de carbone
réagit avec l’eau de chaux pour donner un précipité de carbonate de calcium. On
dit que le dioxyde de carbone trouble l’eau de chaux.
Combustion du soufre
Expérience
On déclenche la
combustion du soufre dans l’air en l’exposant au feu. On introduit la flamme
dans un tube à essai, contenant une solution de permanganate de potassium et du
dioxygène de l’air.
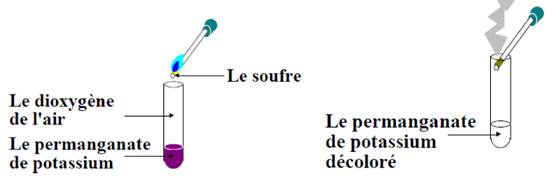
Observations et interprétations :
·
Dans l’air le soufre brûle avec une petite flamme bleu vif. Dans le
dioxygène le soufre brûle avec une flamme bleue plus vive.
·
Le tube devient chaud car il y a eu un dégagement de
la chaleur.
·
Quand on place le produit obtenu dans l’eau, on voit
l’apparition de la fumée blanche
·
Le gaz formé décolore la
solution de permanganate de potassium : c’est le dioxyde de soufre.
Conclusion :
Au cours de la
combustion du soufre, le soufre disparait et il apparait du dioxyde de soufre.
Réactifs : soufre,
dioxygène (comburant)
Produits : dioxyde de
soufre.
Réaction chimique :
Soufre +
dioxygène → dioxyde de soufre
Pas de dépôt de
carbone, donc la combustion est complète.
Il y dégagement
de la chaleur, donc la réaction est exothermique est exothermique.
Test du dioxyde de soufre formé : Le dioxyde de soufre
est un gaz qui se présente sous forme de fumée blanche qui fait suffoquer et
qui irrite les yeux. Ce gaz est mis en évidence par le fait qu’il décolore la
solution violette du permanganate de potassium.
Combustion du butane
dans l’air
Expérience
Allumer un
réchaud à gaz.
Régler la
molette afin que l’arrivée de butane soit assez faible pour avoir suffisamment
de dioxygène pour assurer une bonne combustion ; Placer votre main avec
précaution à quelques dizaines de cm au-dessus de la flamme ;
Placer ensuite
au-dessus de la flamme un tube à essais sec ;
Verser de l’eau
de chaux dans ce tube à essais après avoir recueilli les gaz produits lors de
la combustion.
Observations et interprétation :
a. la couleur de la flamme lors de la
combustion complète du butane dans le dioxygène est bleue On dit alors que la
combustion est complète car l’air est en quantité suffisante.
b. La combustion du butane dégage de la
chaleur.
c. Pendant la
combustion, On observe de la buée sur la paroi du tube à essais. La combustion
du butane produit de l’eau.
d. Un second
produit gazeux est mis en évidence par le test à l’eau de chaux. Il s’agit du
dioxyde de carbone.
Conclusion
La combustion
complète du butane est une transformation chimique au cours de laquelle le
butane réagit avec le dioxygène pour donner du dioxyde de carbone et de l’eau.
Réactifs : butane,
dioxygène
Produits : dioxyde de
carbone, eau
Réaction chimique :
Butane
+dioxygène → dioxyde de carbone+ eau
NB : Le dioxygène
est la substance qui entretient les combustions. Sa présence rend la combustion
très vive, complète alors que son insuffisance conduit à une combustion incomplète.
Dangers des
combustions
Voici les
principaux dangers liés aux combustions :
1. Émanation de
gaz toxiques :
- Monoxyde de carbone : incolore, inodore,
très toxique. Il peut entraîner des maux de tête, des nausées, voire la mort
par asphyxie.
- Dioxyde de soufre ou oxydes d’azote :
irritants pour les voies respiratoires.
2. Production de
particules fines :
- Nocives pour les poumons, elles aggravent
l’asthme, les allergies et les maladies cardiovasculaires.
3. Émissions de
gaz à effet de serre :
- dioxyde de carbone : contribue au
réchauffement climatique.
- Méthane ou autres gaz selon la combustion
: encore plus puissants que le dioxyde de carbone.
4. Risque
d’incendie :
- Une combustion mal contrôlée peut
provoquer des incendies domestiques, industriels ou forestiers.
5. Explosions :
- Certains mélanges air-combustible peuvent
être explosifs (gaz, vapeurs de carburant...).
6. Pollution de
l’air :
- La combustion du bois, charbon, carburant
émet des polluants qui détériorent la qualité de l’air ambiant.
EXERCICES
EXERCICE I : Identifier
les transformations chimiques
Pour chaque
situation ci-dessous, dis s’il s’agit d’une transformation chimique ou
physique. Justifie ta réponse.
1. Le sucre se
dissout dans l’eau.
2. Une bougie
brûle.
3. Le lait
devient caillé.
4. La glace
fond.
5. Le fer
rouille.
6. Le vinaigre
est versé sur du bicarbonate : des bulles se forment.
EXERCICE II :
Transformation physique ou chimique ?
Lis chaque
situation et indique s’il s’agit d’une transformation physique ou chimique.
Justifie ta réponse.
1. Une feuille
de papier est déchirée.
2. Du vinaigre
est mélangé à de l’huile.
3. Une pomme
laissée à l’air noircit.
4. Le sel se
dissout dans l’eau.
5. Le bois brûle
dans une cheminée.
6. Un glaçon est
placé dans un verre à température ambiante.
7. Du jus de
citron est versé sur un morceau de métal et provoque une effervescence.
EXERCICE III: Combustion lente ou vive ?
Pour chaque situation ci-dessous, indique s’il
s’agit d’une combustion lente ou d’une combustion vive. Justifie ta réponse.
1. On allume une
allumette et une flamme apparaît immédiatement.
2. Une barre de
fer rouille lentement à l’air libre.
3. Un feu de
bois brûle dans un foyer.
4. Une pomme
coupée devient brune après quelques heures.
5. Du gaz
explose en présence d’une étincelle.
6. Une bougie
reste allumée pendant plusieurs heures.
7. Un tas de
compost chauffe lentement en se décomposant.
EXERCICE IV :
On allume une
bougie dans un bocal, puis on referme le bocal. Quelques minutes plus tard, la
flamme s’éteint.
Questions :
1. Quelle est la
transformation observée ?
2. Quel est le
comburant dans cette expérience ?
3. Pourquoi la
flamme s’éteint-elle ?
EXERCICE V : Identifier
les produits d'une combustion
Lorsqu’on fait
brûler du carbone dans le dioxygène, on observe la formation d’un gaz incolore
appelé dioxyde de carbone.
Questions :
1. Quel est le
combustible ?
2. Quel est le
comburant ?
3. Quel est le
produit de la combustion ?
4. S'agit-il
d'une combustion complète ou incomplète ? Pourquoi ?
5. Écris
l’équation simplifiée de la combustion du carbone.
EXERCICES VI : Combustion
incomplète du butane
On fait brûler
du butane dans une atmosphère pauvre en dioxygène. On observe la formation de
monoxyde de carbone et de la vapeur d’eau.
Questions :
1. Est-ce une
combustion complète ou incomplète ? Justifie.
2. Quels sont
les produits de la combustion ?
3. Pourquoi le
monoxyde de carbone est-il dangereux ?
4. Écris
l’équation simplifiée de cette combustion incomplète.
EXERCICE VII: Identifier les
dangers des combustions
Lis attentivement les affirmations ci-dessous
et coche celles qui sont vraies.
1. La combustion
peut produire des gaz invisibles mais toxiques.
2. Le dioxyde de
carbone est un gaz à effet de serre.
3. Le monoxyde
de carbone est sans danger s’il est respiré en faible quantité.
4. Une
combustion mal contrôlée peut provoquer un incendie.
5. Les
combustions n’ont aucun impact sur l’environnement.
6. Les
particules fines peuvent être dangereuses pour les poumons.
7. Le dioxygène
est un déchet produit lors d’une combustion.
EXERCICE
VIII : Texte à trous
Complète les
phrases avec les mots suivants :
Monoxyde de
carbone, incendie, dioxyde de carbone, toxique, poumons, effet de serre
1. Une
combustion incomplète peut produire du ___, un gaz très ___.
2. Le ___ est un
gaz qui contribue à l’___.
3. Les fumées
d’une combustion contiennent des particules dangereuses pour les ____.
4. Une étincelle
près d’un carburant peut provoquer un ____.
CORRIGES
EXERCICE I :
Identifier les transformations chimiques
1.
Le sucre se dissout dans l’eau → Physique
Aucune nouvelle substance n’est formée, le
sucre reste du sucre.
2.
Une bougie brûle → Chimique
Il y a production de lumière, de chaleur, et
de nouvelles substances comme le dioxyde de carbone.
3.
Le lait devient caillé → Chimique
Des nouvelles substances se forment, le lait
change de nature (protéines transformées).
4.
La glace fond → Physique
L’eau change d’état (solide à liquide) mais
reste de l’eau.
5.
Le fer rouille → Chimique
Le fer réagit avec l’eau et l’air pour
former un nouveau corps : la rouille.
6.
Le vinaigre est versé sur du bicarbonate : des bulles se forment →
Chimique
Une réaction a lieu et produit un gaz (le
dioxyde de carbone).
EXERCICE II :
Transformation physique ou chimique ?
1.
Transformation physique
2.
Transformation physique
3.
Transformation chimique
4.
Transformation physique
5.
Transformation chimique
6.
Transformation physique.
7.
Transformation chimique
EXERCICE III:
1.
Combustion vive – flamme visible et dégagement de chaleur.
2.
Combustion lente – oxydation progressive sans flamme.
3.
Combustion vive – flamme et chaleur libérées rapidement.
4.
Combustion lente – oxydation lente sans flamme.
5.
Combustion vive – très rapide, souvent explosive.
6.
Combustion vive – flamme continue visible.
7.
Combustion lente – transformation lente avec dégagement discret de chaleur.
EXERCICE IV: Reconnaître une combustion
1.
C’est une combustion.
2.
Le comburant est le dioxygène de l’air.
3.
La flamme s’éteint parce que le dioxygène est épuisé dans le bocal fermé.
EXERCICE V :
1. Le combustible est le carbone.
2.
Le comburant est le dioxygène.
3.
Le produit est le dioxyde de carbone.
4.
Combustion complète : car le dioxyde de carbone est le seul produit observé,
sans fumée ni …
EXERCICES VI :
1.
C’est une combustion incomplète, car il y a manqué de dioxygène et production
de monoxyde de carbone, toxique.
2.
Les produits sont : monoxyde de carbone et vapeur d’eau.
3.
Le monoxyde…
EXERCICE VII: Identifier les dangers des combustions
1. Vrai
2.
Vrai
3. Faux – même en petite quantité, le monoxyde
de carbone est toxique.
4.
Vrai
5.
Faux – elles polluent l’air et réchauffent le climat.
6.
Vrai
7.
Faux – le dioxygène est un comburant, pas un déchet.
EXERCICE
VIII
: Texte à trous
1.
monoxyde de carbone, toxique
2.
dioxyde de carbone, effet de serre
3.
poumons
4.
incendie


