INTRODUCTION A LA CHIMIE ORGANIQUE
Définition
La chimie organique est la chimie des composés
du carbone
Importance de la chimie organique
Nous utilisons les substances organiques pour
nous nourrir (tubercules, céréales, sucre, viandes…) ou pour nous vêtir(coton).
Mais nous disposons, en outre, de toute une gamme de produit fabriqués à partir
des composés organiques, eux-mêmes obtenus par synthèse : matières plastiques ;
textiles synthétiques ; insecticides ; produits pharmaceutiques ;
détergents ; carburants ; colorants…
Analyse élémentaire
Faire l’analyse élémentaire d’une substance,
c’est déterminer sa composition.
On
procède généralement en deux étapes :
-Recherche
des éléments constituant la substance : c’est l’analyse qualitative.
-Déterminer
des proportions relatives des différents éléments (dosage) : c’est l’analyse
quantitative.
Analyse qualitative
Recherche de l’élément carbone
Elle peut se faire soit par combustion, soit
par pyrolyse, soit par oxydation par l’oxyde de cuivre II.
-combustion
- Principe : On chauffe
fortement la substance.
- Observation : Si elle
contient du carbone, on observe la formation de dioxyde de carbone (CO₂).
- Test : Le CO₂
trouble l’eau de chaux (solution devient laiteuse).
Réaction :
C (substance) + O₂ →
CO₂ (gaz)
CO₂ + Ca(OH)₂ → CaCO₃
(précipité blanc)
-pyrolyse
-Mettre un peu de sucre dans
un tube à essai.
-Chauffer doucement le tube
au-dessus de la flamme à l’aide de la pince.
-Observer ce qui se passe
dans le tube (le sucre noircit → formation de carbone).
-oxydation
par l’oxyde de cuivre II
On chauffe la substance organique en présence
d’oxyde de cuivre (II) (CuO), qui est un
oxydant.
→
Le carbone présent dans la substance est oxydé en dioxyde de carbone (CO₂).
Mise
en évidence :
-
Le dioxyde de carbone formé est recueilli et bulle dans l’eau de chaux.
-
Si l’eau de chaux se trouble, c’est la preuve de la présence de carbone dans la
substance
Réaction
simplifiée :
C
(de la substance) + 2 CuO → CO₂
+ 2 Cu
Recherche de l’élément hydrogène
Pour mettre en évidence l’hydrogène dans une
substance, on peut utiliser une expérience simple basée sur la détection du
dihydrogène (H₂), qui est un gaz inflammable.
Vérifier
la présence d'hydrogène dans une substance en observant un dégagement gazeux
inflammable
-Mettre
un petit morceau de zinc dans un tube à essai.
-Ajouter
quelques millilitres d’acide chlorhydrique dilué.
-Dès
que des bulles se forment (gaz), approcher une allumette enflammée à
l’ouverture du tube.
Observation
:
-
Il se produit un "pop" sonore ou petite explosion à l’approche de l’allumette.
Recherche de l’élément azote.
Lorsqu’on chauffe une substance organique
azotée avec de la soude (NaOH), il se dégage de
l’ammoniac (NH₃) si l’azote est présent.
-Dans
un tube à essai, mettre un peu de la substance à tester.
-Ajouter
de la soude concentrée (NaOH).
-Chauffer
doucement.
-Approcher
un papier pH ou du papier imbibé de sulfate de cuivre anhydre à l’embouchure du
tube.
Résultat
attendu :
-
Dégagement de gaz ammoniac…
Recherche de l’élément oxygène
Pour mettre en évidence l’oxygène contenu dans
un solide (par exemple un oxyde métallique), on utilise une réduction chimique.
Exemple
: oxyde
de cuivre (CuO)
-Mélanger
de la poudre de CuO avec du carbone en poudre.
-Placer
le mélange dans un tube à essai.
-Chauffer
fortement le mélange avec un bec Bunsen.
-Observer
les dépôts dans le tube et le gaz dégagé.
Reaction chimique :
CuO (s) + C (s) → Cu (s) + CO (g)
Observations
:
-
Apparition d’un métal cuivré → réduction de CuO.
-
Le gaz dégagé est du monoxyde de carbone (CO) ou du dioxyde de carbone (CO₂)
→ preuve que l’oxygène était présent dans le CuO
Analyse quantitative
Dosage de carbone et de l’hydrogène
Ces dosages se font simultanément. La
substance, préalablement desséchée et pesée avec précision, est oxydée. Tout le
carbone qu’elle contient est transformé en dioxyde de carbone absorbé dans des tubes
a potasse, tandis que tout l’hydrogène est transformé en eau, absorbée dans
les tubes à ponce sulfurique. Les masses de dioxyde de carbone et de
l’eau formés correspondent à l’augmentation de masse des tubes absorbeurs.
Soit m la masse de la substance, mCO2
et mH2O les masses respectives de dioxyde de carbone et de l’eau
formés.
Connaissant les masses molaires
atomiques : Mc=12g/mol ; MO=16 g/mol et MH=1g/mol,
on détermine les masses molaires moléculaires MCO2=44 g/mol et MH2O=18
g/mol.
La masse de l’élément carbone dans mCO2
est :
![]()
Cette masse est aussi contenue dans la masse m
de la substance. On déduit le pourcentage en masse de l’élément carbone dans la
substance :
![]()
La masse de l’élément hydrogène dans mH2O
est :
![]()
D’où :
![]()
Dosage de l’azote
Deux méthodes sont
utilisées :
-L’oxydation de la
substance conduit généralement au diazote N2, dont on mesure le volume.
La détermination de sa masse nécessite la connaissance précise des conditions
de l’expérience.
- la substance est traitée de façon que
l’azote passe à l’état d’ammoniac, qui est ensuite dosé par un acide.
Dosage de l’Oxygène
Il se fait généralement par différence,
les autres pourcentages étant connus.
EXERCICES
EXERCICE
I :
1.
On
brûle un échantillon d'une substance organique dans un tube à combustion. Un
flacon contenant de l'eau de chaux est placé en sortie. On observe un trouble
dans l'eau de chaux. Que peut-on
conclure sur la composition de la substance ?
2. Un élève chauffe du sucre dans un tube à
essai. Il observe un noircissement et la formation de buée sur les parois. Quelles sont les deux conclusions qu’il peut
tirer sur la composition du sucre ?
3.Un échantillon est chauffé avec du dioxygène.
Les gaz produits sont dirigés dans de l’eau de chaux, qui devient trouble.
Quelle est la réaction chimique mise en jeu ?
Quelle conclusion peut-on tirer sur l’échantillon ?
EXERCICE II :
1 : On place un peu de
glucose (sucre) dans un tube à essai. On chauffe fortement avec un bec Bunsen.
On observe un noircissement et un liquide qui se condense sur les parois.
Question 1 : Décrire ce qu’on observe.
Question 2 : Quelle conclusion peut-on tirer
sur la composition du glucose ?
Question 3 : Quelle expérience complémentaire
permettrait de mettre en évidence le dioxyde de carbone formé ?
2. On
réalise la combustion d’un échantillon organique dans un tube fermé. Les gaz
sont envoyés dans un flacon contenant de l’eau de chaux.
Après quelques minutes, l’eau de chaux devient
laiteuse. Explique l’utilité de l’eau de chaux dans cette expérience. Que
démontre cette observation ?
3 : On réalise deux expériences de chauffage
dans un tube à essai :
- Tube 1 : contient du sucre
- Tube 2 : contient du sel (NaCl)
On chauffe les deux tubes et on observe.
Dans le tube 1, le contenu noircit et forme de
la buée. Dans le tube 2, rien ne change.
Question :
Explique les différences d’observation entre
les deux tubes.
EXERCICE III :
1.On souhaite savoir si la gélatine, une
protéine, contient de l’azote.
On réalise l’expérience suivante :
-On place un peu de gélatine dans un tube à
essai.
-On ajoute quelques millilitres de soude (NaOH).
-On chauffe le mélange doucement.
-On
approche un papier pH humidifié à l’embouchure du tube.
Questions :
a. Quelle observation peut-on faire au niveau
du papier pH ?
b. Quel est le gaz formé ? Quelle est son odeur
?
c. Quelle conclusion peut-on tirer sur la
composition chimique de la gélatine ?
2.Un élève veut vérifier si un échantillon
d’engrais contient de l’azote.
-Il place une petite quantité d’engrais dans un
tube à essai.
-Il ajoute de la soude (NaOH)
et un peu de limaille de fer.
-Il chauffe doucement.
-Il approche un papier pH humidifié ou il teste
les gaz dégagés à l’aide d’une tige de verre imbibée d’acide chlorhydrique.
Questions :
a. Quel gaz est libéré ?
b. Quelle est l'observation avec l’acide
chlorhydrique ?
c. Quelle conclusion tirer sur l’engrais ?
3.On veut savoir si la laine, un produit
d’origine animale, contient de l’azote.
-On met un petit morceau de laine dans un tube
à essai.
-On ajoute un peu de soude (NaOH).
-On chauffe et on approche un papier pH
humidifié.
Questions :
a. Quelle odeur se dégage ?
b. Que devient le papier pH ?
c. Quelle conclusion peut-on tirer ?
EXERCICE IV :
1. Une combustion complète de 0,500 g d’un
composé organique produit 1,100 g de CO₂.
a-Déterminer la masse de
carbone présente dans le composé initial.
b-Déterminer le
pourcentage de carbone présent dans le composé initial.
Données :
- Masse molaire du CO₂
= 44,0 g/mol
- Masse molaire du C = 12,0 g/mol
2 : On
fait brûler 0,800 g d’un composé organique et on obtient 1,320 g de dioxyde de
carbone.
Déterminer le pourcentage massique du carbone
dans le composé.
Données :
- M(CO₂) = 44 g/mol
- M(C) = 12 g/mol
3.Un composé organique
contient 52,17 % de carbone, 13,04 % d’hydrogène, le reste étant de
l’oxygène.
Sa masse molaire est 46 g/mol.
Déterminer sa formule brute.
EXERCICE V :
1.La combustion complète de 0,400 g d’un
composé organique donne :
- 0,880 g de CO₂
- 0,360 g de H₂O
Déterminer la formule brute de ce composé.
Données :
- M(CO₂) = 44 g/mol → contient
12 g/mol de C
- M(H₂O) = 18 g/mol →
contient 2 g/mol de H
- M(C) = 12 g/mol, M(H)
= 1 g/mol, M(O) = 16 g/mol
2. on analyse 0,100 g d’un composé organique.
On obtient :
-0,220 g de de CO2
-0090 g de H2O
-0,035 g de N2
Donner la formule brute de ce composé.
EXERCICES
VI :
1.
Déterminer
la composition centésimale massique du saccharose de formule C12H22O11.
2.
Les
boules blanches que nous mettons dans nos vêtements sont généralement constituées
de paradichlorobenzène, de formule brute C6H4Cl2.
Déterminer le pourcentage en masse de chacun des éléments de ce composé.
3.
L’éthanol
est composé de carbone, d’hydrogène et d’oxygène. Il contient 52,2% de carbone
et 13,0% d’hydrogène. Déterminer sa formule brute, si sa masse molaire vaut 46
g.mol-1.
EXERCICES
VII :
La combustion de 0,850
g d’un composé gazeux produit 1,66 g de dioxyde de carbone et 1,19 g d’eau. Ce
composé est azoté. Par une méthode appropriée, on transforme l’azote qu’il
contient en ammoniac NH3. Le traitement de 0,850 g de la substance
produit 0,321 g d’ammoniac.
1.Déterminer le pourcentage de carbone de
l’hydrogène et d’azote contenus dans le composé étudié. Contient-il de
l’oxygène ?
2.Déterminer sa formule brute, sachant que sa
densité vaut 1,55.
EXERCICE
VIII :
Une
substance renfermant 38,7% de carbone possède en outre les éléments hydrogène
et azote. On traite 0,259 g de cette substance de façon à libérer l’azote sous
forme de diazote, qui occupe 115 cm3 à 25oC sous une
pression de 930 hPa.
1.Determiner
la quantité de matière en mol de diazote contenue dans le diazote libérée.
2.Sachant
qu’une molécule de la substance étudiée renferme un seul atome d’azote,
déterminer sa masse molaire.
3. En déduire sa formule brute.
On
rappelle la constante des gaz parfaits : R=8,31 SI
CORRIGES
EXERCICE I :
1.Le trouble de l’eau de chaux
indique la formation de CO₂.
→ Conclusion : La substance
contient du carbone, car sa combustion a produit du dioxyde de carbone, qui
trouble l’eau de chaux.
2.
- Le noircissement est dû au
carbone libéré : → présence de carbone.
- La buée montre la présence de
vapeur d’eau : → présence d’hydrogène (dans H₂O).
Donc, le sucre contient carbone
et hydrogène.
3.
Réaction chimique : C + O₂ → CO₂
L’eau de chaux se trouble →
présence de CO₂
Conclusion : L’échantillon
contient du carbone.
EXERCICE II :
1 :
a-
Noircissement (carbone libéré), gouttelettes sur les parois (eau).
b-Le glucose
contient du carbone (car charbon noir formé) et de l’hydrogène (eau
formée).
c-Faire
passer les gaz dans de l’eau de chaux → elle se trouble si CO₂ est présent.
2.
L’eau de chaux détecte le CO₂.
Le trouble observé prouve que du
dioxyde de carbone a été formé, donc que la substance contenait du carbone.
3 .
- Le sucre est une substance
organique, donc contient carbone et hydrogène → noircissement (carbone),
buée (H₂O).
- Le sel est un composé minéral,
il ne contient pas de carbone → aucune transformation visible.
→ Seules les substances
organiques contiennent du carbone détectable par chauffage.
EXERCICE III :
1.Mise en évidence
de l’azote dans une protéine
a- Le
papier pH devient bleu → présence d’un gaz basique.
b- Le gaz
formé est l’ammoniac (NH₃), à
l’odeur piquante.
c-L’ammoniac vient de
l’azote contenu dans la gélatine.
→ La gélatine contient donc de l’azote
2.Test de l’azote
dans un engrais azoté
a-Gaz : ammoniac
(NH₃).
b-L’acide réagit
avec le NH₃ pour
former des fumes blanches (chlorure d’ammonium).
c-L’engrais contient
bien de l’azote, car l’ammoniac en est issu.
3.Détection d’azote
dans la laine
a- Odeur
piquante d’ammoniac.
b-Le papier
devient bleu → présence d’un gaz basique.
c-Conclusion
: la laine contient de l’azote
EXERCICE IV :
1 .
a- n(CO₂) = 1,100 / 44 = 0,025 mol
Chaque mole de CO₂ contient 1 mol de C ⇒ n(C) = 0,025 mol
m(C) = n × M = 0,025
× 12 = 0,300 g de carbone
![]() =60%
=60%
// autre méthode
![]() =
=![]() =0,3g
=0,3g
![]() =
=![]() =60%
=60%
2 : n(CO2)=1,320/44=0,03 mol
n(C)=0,03
mol
m(C)=0,03x12=0,36
g
%C=(0,36/0,800)x100=45%
3.
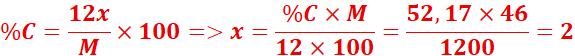
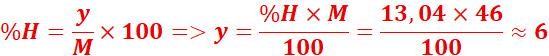
![]()
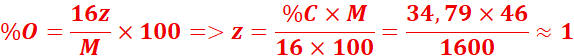
→ Formule brute = C₂H₆O
EXERCICE V :
1. Déterminer les masses de C et H
a. Masse de carbone dans CO₂ :
CO₂ contient 12 g de C pour 44 g de CO₂
→ m(C) = (12/44) × 0,880 g ≈
0,24 g
b. Masse d’hydrogène dans H₂O :
H₂O contient 2 g de H pour 18 g de H₂O
→ m(H) = (2/18) × 0,360 g ≈
0,04 g
- Masse de l'élément manquant
(Oxygène)
m(O) =
masse du composé – m(C) – m(H)
m(O) =
0,400 – 0,24 – 0,04 = 0,12 g
-Déterminer les moles de C, H et
O
- n(C) =
0,24 / 12 = 0,020 mol
- n(H) =
0,04 / 1 = 0,040 mol
- n(O) =
0,12 / 16 = 0,0075 mol
-Déterminer les rapports simples
Divisons par le plus petit :
0,0075
- C : 0,020 / 0,0075 ≈ 2,67
- H : 0,040 / 0,0075 ≈ 5,33
- O : 0,0075 / 0,0075 = 1
→ On multiplie tout par 3
pour obtenir des entiers :
- C ≈
8
- H ≈
16
- O = 3
Formule brute
: C₈H₁₆O₃
2 .
1. C : 0,220 / 44 = 0,005 mol
2. H : 0,090 / 18 = 0,005 mol × 2 = 0,010 mol
3. N : 0,035 / 28 = 0,00125 mol
Rapport :
- C : 0,005 / 0,00125 = 4
- H : 0,010 / 0,00125 = 8
- N : 0,00125 / 0,00125 = 1
→ Formule brute : C₄H₈N
EXERCICE VI :
1. ![]()
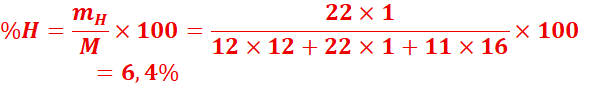
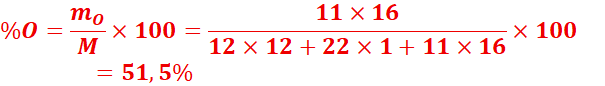
2.
![]()
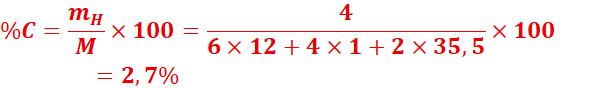
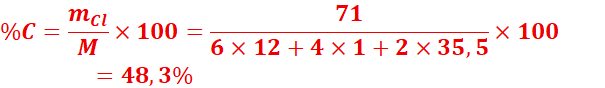
3.Soit CxHyOz la formule brute de
ce corps
%O=100-(52,2+13) =34,8%
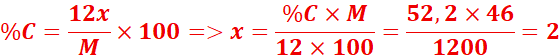
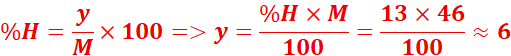
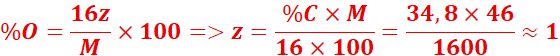
La formule est C2H6O
EXERCICE VII :
1.Déterminons le
pourcentage de carbone, de l’hydrogène et d’azote contenus dans le composé
étudié.
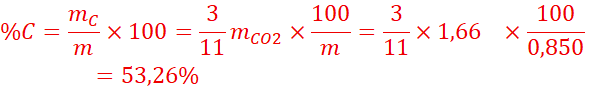
![]() =
=![]() =15,56%
=15,56%
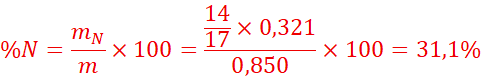
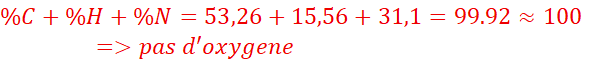
2. formule brute :CxHyNz
M=29d=29x1,55=44,95
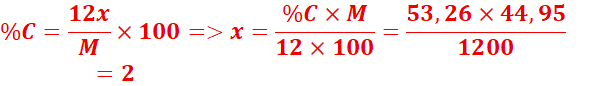
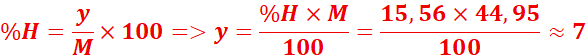
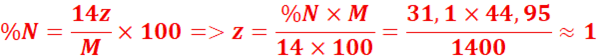
Formule
brute :C2H7N
EXERCICES VIII :
1.Commençons par déterminer la quantité de matière de diazote (N₂) à l'aide de l'équation des gaz
parfaits :
Données :
- V(N₂) = 115
cm³ = 0,000115 m³
- T = 25°C = 298 K
- P = 930 hPa = 93 000 Pa
- R = 8,31 J·mol⁻¹·K⁻¹
Équation des gaz parfaits :
PV = nRT → donc n = PV / RT
Remplaçons les valeurs :
n = (93 000 × 0,000115) / (8,31 ×
298)
n ≈ (10,695) / (2477,38) ≈
0,004316 mol
2. Masse molaire de la substance :
n(N) = 0,00864 mol (car 1 mol de N₂ = 2 mol de N)
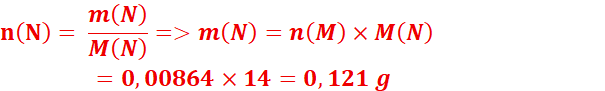
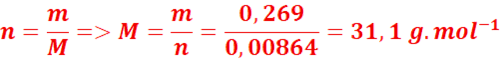
4.
Formule brute : CxHyNz
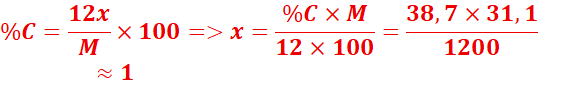
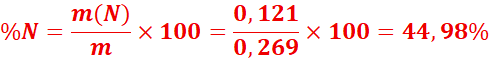
![]()
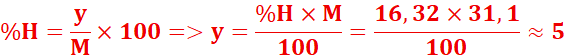
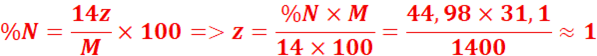
Formule brute :CH5N
Avez-vous
un exercice à proposer ?Cliquez-ici
Merci de votre visite
Laissez un commentaire