FORCE
D’UN ACIDE ET D’UNE BASE
Acide :
Selon la théorie de Brönsted, un acide est tout
corps susceptible de céder un proton H+ au cours d’une réaction
chimique.
Exemple : L’acide chlorhydrique HCl
HCl → H+ +
Cl-
Au cours de cette réaction, la molécule d’eau
arrache un proton H+ a la molécule de chlorure d’hydrogène pour
former l’ion hydronium H3O+. Ainsi, la molécule de HCl a cédé son proton à l’eau, HCl
est un acide au sens de Brönsted.
L’équation
bilan de la mise en solution du HCl est :
HCl + H2O → H3O+ +
Cl-
Les solutions acides sont des solutions
aqueuses ioniques qui contiennent des ions hydrogène H3O+
et des ions négatifs qui les accompagnent pour que la solution soit globalement
neutre électriquement.
Autres
acides :
acide sulfurique H2SO4
acide
nitrique :HNO3
Base :
Selon la théorie de Brönsted, une base est tout
corps susceptible de fixer des protons H+ au cours d’une réaction
chimique.
Exemple : L’hydroxyde de sodium NaOH
L’équation de mise en solution de NaOH est :
NaOH
→ Na+ + HO-
Les ions HO- réagissent sur les
protons H+ pour former de l’eau selon l’équation :
HO-
+ H+ →H2O
Les ions HO-
sont susceptibles de fixer des protons : NaOH
est une base au sens de Brönsted.
Les propriétés de la solution aqueuse obtenue sont
essentiellement celles des ions HO-.
Les ions Na+ étant très peu réactifs.
Les solutions basiques sont des solutions
aqueuses ioniques qui contiennent des ions hydroxyde HO- et des ions
positifs qui les accompagnent pour que la solution soit globalement neutre
électriquement
Autres bases : Ammoniac : NH3
Hydroxyde de potassium ou Potasse : KOH
Amphotère :
C’est une substance qui peut se
comporter selon les conditions comme un acide de Brönsted et comme une base de
Brönsted.
Exemple :
Une molécule
d’eau s’ionise en libérant un proton selon l’équation :
H2O → HO- + H+
Le proton
libéré est solvaté (hydraté) par une autre molécule d’eau selon
l’équation :
H2O
+ H+→H3O+
Au cours de la première étape, l’eau cède un proton,
elle se comporte comme un acide au sens de Brönsted. Au cours de la seconde
étape, l’eau fixe un proton, elle se comporte comme une base au sens de
Bronsted. L’eau peut se comporter, tantôt comme un acide, tantôt comme une
base : c’est une substance amphotère.
Remarque :
On précise à
chaque fois « au sens de Brönsted « parce qu’il existe une autre
définition hors-programme des acides et bases au sens d’Arrhenius.
Acide fort
On appelle acide fort tout acide dont
la réaction avec l’eau est totale.
Exemples : HCl, H2SO4 … sont des acides forts.
Réaction entre le chlorure hydrogène
et l’eau
HCl + H2O→H3O+
+ Cl-
Cette équation montre qu’en solution aqueuse, toutes les molécules HCl sont totalement ionisées.
La solution de HCl est représentée (H+ + Cl-)
NB : Le proton H+ s’associe à une molécule d’eau pour donner l’ion
hydronium H3O+
La solution de HCl devient (H3O+
+ Cl-)
Soit Ca, la concentration en
ions H3O+,
c.-à-d. Ca = [H3O+]
pH=-log[H3O+]
=> pH=-logCa
Remarques :
-Cette formule ne s’applique pas à des solutions très diluées (Ca<10-6 mol.l-1),
ni à des solutions très concentrées (Ca>5.10-2
mol.l-1)
-Elle n’est pas valable pour les polyacides.
Exemples : H2SO4
nH3O+=2nH2SO4 => pH=-log2Ca
Base
forte
On appelle base forte toute base dont la
réaction avec l’eau est totale.
En solution aqueuse toutes les molécules d’une base forte sont totalement
ionisées.
Exemples : NaOH, KOH…sont des bases fortes.
L’ionisation dans l’eau d’une solution d’hydroxyde de sodium est une
réaction totale d’équation :
NaOH →
Na+ +HO-
La solution d’hydroxyde de sodium est représentée (Na+ + HO-)
Soit Cb, la concentration en ions OH-, c.-à-d.
Cb =[OH-]
A 25°C, [OH-]=10-14/[H3O+]
=>[H3O+] =10-14/[OH-]=10-14/Cb =>
pH=-log[H3O+] => pH=-log10-14/cb => pH=14 + logCb
Remarques :
-Cette formule ne s’applique pas à des solutions très diluées (Cb<10-6
mol.l-1), ni à des solutions très
concentrées (Cb>5.10-2 mol.l-1)
-Elle n’est pas valable pour les polybases.
Exemples : Ca(OH)2
NHO-=2n Ca(OH)2 , ![]() => pH=14+log2Cb
=> pH=14+log2Cb
Acide faible
Plus généralement, on appelle acide
faible tout acide dont la réaction avec l’eau est partielle.
Un acide AH est faible si en solution
aqueuse il est partiellement dissocié en ions H+ et en une
base conjuguée A- .
AH + H2O ⇆ A- +
H3O+
Example : acide éthanoïque (CH3COOH)
CH3COOH
+ H2O⇆CH3COO- + H3O
Base faible
Plus généralement, on appelle base
faible toute base dont la réaction avec l’eau est partielle.
Une base A- est
faible si en solution aqueuse elle s’associe partiellement à des ions H+ en
produisant un acide conjugué AH.
A- + H2O
⇆ AH + HO-
Exemple : ion ethanoate (CH3COO-)
CH3COO- + H2O ⇆ CH3COOH +HO-
Degré d’ionisation
Le degré
d’ionisation d’un acide ou d’une base est le nombre de moles dissociées par
rapport au nombre de môles initiales.
α=ndissocie/ninitial
Cas
d’un acide
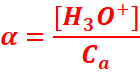
[H3O+] : concentration
des ions H3O+ dans la solution en fin de réaction
Ca : concentration
initiale de l’acide avant sa réaction avec l’eau
Cas
d’une base
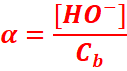
[HO-] : concentration des ions HO- dans la solution en fin de
réaction
Ca : concentration
initiale de l’acide avant sa réaction avec l’eau
Remarque :
Le degré d’ionisation augmente avec la dilution
EXERCICES
EXERCICE I :
On dispose des solutions acides et bases
suivantes :
-A : acide chlorhydrique :C1=1,0.10-2
mol/l ; pH1=2,0
-B : acide éthanoïque :C2=5,0.10-2
mol/l ; pH2=3,1
-C : hydroxyde de sodium :C3=1,0.10-2
mol/l ; pH3=12,0
-D : ammoniac :C4=1,0.10-2
; pH4=11,1
Donner, en justifiant, la force de chaque acide et
de chaque base.
EXERCICE II :
On met en solution1 l de chlorure d’hydrogène pour
obtenir 1 l d’une solution S0 d’acide chlorhydrique.
1.Determiner la concentration molaire de la solution
S0 sachant que dans les conditions de l’expérience, le volume
molaire est Vm=25 l/mol.
2.Determiner le pH de la solution S0.
3-Existe-t-il des molécules de HCl
dans S0 ? Conclure
EXERCICE III :
Une solution commerciale d’hydroxyde de sodium a une
densité d=1,38 et titre 35% d’hydroxyde de sodium en masse c.-à-d. que 1 kg de
la solution contient 0,35 kg
d‘hydroxyde de sodium.
1.Quelle est la concentration de cette solution
commerciale ?
2.Quel volume V1 de cette solution faut-il
diluer dans l’eau pour obtenir 1 l de solution S1 de pH=12,5 ?
3.On verse 5 ml de la solution commerciale dans 1 l
d’eau. Quel est le pH de la solution S2 obtenue ?
4. Existe-t-il des molécules de NaOH
dans S2 ? Conclure.
EXERCICE IV :
On dissout de l’acide éthanoïque CH3COOH
dans l’eau. On obtient une solution de concentration Ca=10-2
mol/l, son pH est 3,4.
1.Donner l’équation d’ionisation de l’acide
éthanoïque dans l’eau.
2.Quelles sont les espèces chimiques en
solution ?
3.Calculer les concentrations des espèces en
solution
4.Calculer le pourcentage de dissociation de l’acide
éthanoïque.
Déduire que c’est un
acide faible.
EXERCICE V :
On dissout dans l’eau pure 1,125 g l’isomère CH3-CH2-NH2
de l’amine C2H7N ; le volume de la solution obtenue est
250 cm3. Le pH de la solution est 11,9.
1.Determiner la concentration molaire de la
solution.
2.Ecrire l’équation de la réaction accompagnant la
mise en solution de cette amine dans l’eau
3.Recenser les différentes espèces chimiques
présentes dans la solution et déterminer leurs concentrations molaires.
4. Calculer le pourcentage de dissociation de
l’amine. Conclure
On donne :C=12,0 g.mol-1 ;
H=1,0 g.mol-1 ; N=12 g.mol-1 .
CORRIGES
EXERCICE
I :
1-Cas des solutions acides : deux méthodes sont applicables :
1ere
méthode : On compare les concentrations [H3O+]
à celle Ca des solutions acides
considérées :
-solution A : On a : [H3O+]
=10-pH=10-2 mol/l=c1
=>[H3O+] =c1=1,0.10-2
mol/l
La réaction de l’acide avec l’eau est
totale.
L’acide chlorhydrique est un acide fort.
-solution B : On a : [H3O+]=10-pH=10-3,1=7,9.10-4
mol/l
=>[H3O+] <c2=5,0.10-2
mol/l
La réaction de l’acide avec l’eau est
limitée.
L’acide éthanoïque est un acide faible.
2eme
méthode : On compare le pH de la solution à la
valeur (-logCa).
-solution A :on a :-logc1=-log1,0.10-2=2=pH
=>pH1=-logc1 =>[H3O+] =c1
La réaction d’ionisation est totale.
L’acide chlorhydrique est un acide fort.
-solution
B : on a :-logc2=-log5,0.10-2=1,30<
pH2=3,1
=>-logc2<pH2
=>[H3O+] < c2
L’acide éthanoïque est un acide faible.
2-Cas des
solutions basiques : deux méthodes sont applicables
1ere
méthode : On compare les concentrations [HO-]
à celle Cb des solutions basiques considérées :
-solution C : On pose : [HO-]=Ke/[H3O+]=10-Ke/10-pH=10-14/10-12=10-2
mol/l=c3 =>[HO-]=c3.
La réaction produit une mole d’ions HO-
par mole de base introduite en solution :
C’est une réaction totale.
L’hydroxyde de sodium est une base forte.
-solution D : On pose : [HO-]=Ke/[H3O+]=10-Ke/10-pH=10-14/10-11,6=1,26.10-3
mol/l<c4 =>[HO-]<c4.
La réaction produit moins de mole d’ions
HO- que de moles de base introduites en solution :
C’est une réaction limitée.
L’ammoniac est une base faible.
2eme
méthode : On compare le pH de la solution à la
valeur (14 +logCb) :
-solution C: on a :14+logc3=14+log(1,0.10-2)=12=pH3
L’hydroxyde de sodium est une base forte.
-solution
D : on a :14+logc4=14+log(10-1)=13>pH4=11,1 =>pH4
<14+logc4.
L’ammoniac est une base faible.
EXERCICE II :
1.
n=VHCl/Vm
C=n/V=VHCl/V.Vm=1/1.25=0,04 mol/l
2. pH de la solution S0.
HCl +H2O→H3O+ + HO-
pH=-log[H3O+]=-logC=-log0,04=1,4
3- Non. Le HCl
est complètement dissocié dans la solution.
C’est un acide fort.
EXERCICE
III :
1-
1 kg de cette solution contient 0,35 kg
d’hydroxyde de sodium pur.
d=m/m0 =>m=m0d=ρ0Vd
n=m/M=0,35m/40=0,35x ρ0Vd/40
C1=n/V==0,35x
ρ0d/40==0,35x 1000x1,38/40=12,1 mol/l
2.
C1V1=C2V2 =>V1=
C2V2/C1
[H3O+]=10-pH=1012,5
C2=[HO-]=10-14/[H3O+]
=10-14/10-12,5=10-1,5=0,032 mol/l
V1= C2V2/C1=0,032x1/12,1=0,0026
l=2,6 ml.
3. C3=C1V1/V3=12,1x5/1000=0,06
mol/l
[H3O+]
=10-14/0,06=16,67. 10-14
pH=-log16,67.10-14=12,8
ou pH=14+log0,06=12,8.
4.Non. Le NaOH est
complétement dissocie dans la solution.
C’est une base forte.
EXERCICE IV :
1.CH3-COOH + H2O→H3O+ + CH3COO-
2.CH3COOH;
H2O; H3O+; CH3COO- et HO-
3.-A partir de la définition du pH, nous
avons :
[ H3O+] =10-pH=10-3,4=4,0.10-4
mol/l.
-Le produit ionique de l’eau donne : [ H3O+][[H1] HO-]=10-14
=>[HO-] =10-14 /.[ H3O+]=10-14 /4.10-4=2,5.10-11
mol/l.
-L’équation d’électroneutralité (EEN)
donne :
[ H3O+]
=[HO-] +[ CH3COO-]
=> [CH3COO-]=[ H3O+]
-[HO-]
La solution est acide, [HO-]
<< [ H3O+]
Donc
[CH3COO-] ≈[ H3O+]
=4.10-4 mol/l.
-L’équation de conservation de la matière
(ECM) donne :
(nCH3COOH)i =(nCH3COOH)f +(nCH3COO-)
=>(nCH3COOH)i =Ca=(nCH3COOH)f +(nCH3COO-)
=>[CH3COOH]i =Ca=[CH3COOH]
+[CH3COO-]
=>[CH3COOH] =Ca - [CH3COO-] =10-2 - 4.10-4=9,6.10-3
mol/l
4. pourcentage de dissociation de l’acide
éthanoïque.
α=[H3O+]
/Ca=4.10-4/10-2=0,04
soit 4%
Dans 1
litre de solution seule 4% de molécules de CH3COOH sont ionisées, ce
qui est très faible. L’acide éthanoïque est un acide faible.
EXERCICE
V :
1.Concentration molaire de la solution.
M=2x12+7+14=45 g.mol-1.
C=n/M=m/MV=11,9/45x0,25=0,1 mol/l.
2.Equation de la réaction accompagnant la mise
en solution de cette amine dans l’eau
CH3-CH2-NH2
+H2O→ CH3-CH2-NH+3
3.Recencer les différentes espèces
chimiques présentes dans la solution et déterminer leurs concentrations
molaires.
Especes
presentes: H3O+ ;HO- ;
CH3-CH2-NH+3; CH3-CH2-NH2
Calcul des concentrations:
A partir de la définition du pH, nous
avons :
[ H3O+] =10-pH=10-11,9=1,3.10-12
mol/l.
-Le produit ionique de l’eau donne : [ H3O+][[H2] HO-]=10-14
=>[HO-] =10-14 /.[ H3O+]=10-14 /10-11,9=8.10-3
mol/l.
-L’équation d’électroneutralité (EEN)
donne :
[ CH3-CH2-NH+3]
+[ H3O+] = [HO-]
La solution est acide, [
H3O+]<<[HO-]
Donc
[ CH3-CH2-NH+3] ≈[HO-] =8.10-3
mol/l.
-L’équation de conservation de la matière
(ECM) donne :
[ CH3-CH2-NH+3] + [CH3-CH2-NH2]
=Cb
=>[CH3-CH2-NH2]
=Cb - [ CH3-CH2-NH+3]
= 10-1-8.10-3=9,2.10-2
mol/l
4. α=[HO-]/Cb=8.10-3/0,1=0,08
soit 8%
L’amine se comporte comme une base faible.
Merci de votre visite
Laissez un commentaire