REACTION ENTRE UNE SOLUTION D'ACIDE
CHLORYDRIQUE
ET UNE SOLUTION D'HYDROXYDE DE SODIUM
ETUDE DE LA REACTION
L’acide chlorhydrique,
de formule HCl contient des ions hydronium H3O+
et des ions chlorure Cl-, la solution d’hydroxyde de sodium de
formule NaOH contient des ions hydroxydes HO- et
des ions sodium Na+. Les propriétés acides de l’acide chlorhydriques
sont celles des ions hydroniums, les propriétés basiques des solutions
d’hydroxyde de sodium sont celles des ions hydroxyde.
Lorsqu’on mélange l’acide chlorhydrique et
l’hydroxyde de sodium,
-il y a une transformation chimique qui produit
de la chaleur et de l’eau : la réaction est exothermique.
-la solution obtenue est neutre(pH=7).
-il y a formation du sel : le chlorure de
sodium NaCl
Equation bilan de la réaction
La réaction se traduit
par :
(H3O+ + Cl- ) + (Na+ +
HO-)
→ 2H2O + Na+ + Cl-
Les réactifs de la
réaction acide base sont les ions hydroniums H3O+ et les
ions hydroxydes HO-. Le produit de la réaction acide base est l’eau.
On a le
bilan de la transformation chimique :
ion hydronium + ion
hydroxyde → eau
On a l’équation-bilan de la réaction acide base :
H3O+ + HO-
→ 2H2O
Les ions Na+ et Cl- ne sont pas intervenus : ce sont
des ions spectateurs.
L’équivalence acido-basique
On dit qu’on a obtenu
l’équivalence acido-basique lorsque les réactifs sont mélangés dans des
proportions stœchiométriques c.-à-d, ici, lorsque les quantités de matière
d’ions hydronium et d’ions hydroxydes ont égales.
A l’équivalence : nH3O+ = nHO-
Pour mettre en évidence l’équivalence
acido-basique, on utilise un indicateur coloré (IC).
Dans ce cas précis, le bleu de bromothymol vire
du jaune au bleu.
DOSAGE ACIDO-BASIQUE
Effectuer un dosage
c’est déterminer la concentration molaire d’une espèce dans une solution.
Principe d’un dosage acido-basique
Pour doser une solution
acide, on utilise une solution basique titrée, c.-à-d. une solution basique de
concentration Ca connue. Soient Vb
le volume de la solution basique qu’il faut verser dans un volume Va de la
solution acide pour atteindre l’équivalence et Ca la
concentration de la solution acide à déterminer.
A l’équivalence : nH3O+ = nHO-
Or nH3O+ =CaVa
et nHO- =CbVb => CaVa =CbVb
Remarques :
1.Cette formule n’est valable que dans les cas
d’un monoacide et d’une monobase.
Dans le cas d’un polyacide ou d’une polybase, il faut tenir compte de la quantité de matière
d’ions hydronium ou d’ions hydroxyde libérés par mole d’acide ou de base.
2.Pour doser une solution basique, on place
cette solution dans l’erlenmeyer et on y verse une solution d’acide titrée
contenue dans la burette.
Etude expérimentale :
On désire doser l’espèce à titrer A (HCL) par l’espèce
titrante B(NaOH) :
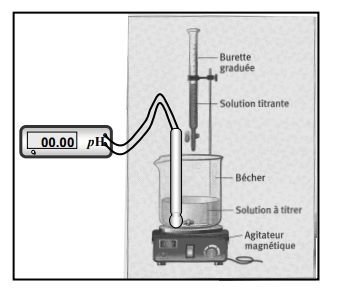 .
.
Matériel : Burette graduée, bécher,
agitateur magnétique, pH-mètre, IC
Procédure :
a. On introduit 20 cm3 d’acide chlorhydrique de
concentration Ca inconnue + quelques gouttes de
phénolphtaléine (IC).
b. On place dans une burette la solution de NaOH, de concentration connue Cb=0,1mol-1,
jusqu’à faire le plein de la burette.
c. On laisse couler la solution de soude jusqu’au virage de
de l’indicateur de l’[H1] incolore
au rouge violace, et on note le volume Vb de descente
de la burette.
Dans la pratique, dans une première étape on verse la base
cm3 par cm3 pour repérer grossièrement la zone de virage.
On reprend la procédure et on verse d’abord cm3 par cm3,
puis goutte à goutte lorsqu’on approche la zone de virage.
Si le volume versé est 22 cm3
On a : CaVa =CbVb => Ca= CbVb/Va=0,1x22/20=0,11 mol.l-1.
Evolution des quantités de matière
lors du dosage
· Avant
l’équivalence : le réactif en défaut est l’ion hydroxyde, le réactif en excès
est l’ion H3O+. L’ion hydroxyde est consommé au fur et à
mesure qu’il est introduit. L’ion H3O+ réagit
partiellement avec l’ion hydroxyde, il en reste en solution.
Contenu du bécher : H3O+, Cl- (ions
présents au départ dans l’acide chlorhydrique, leur quantité reste constante
puisqu’ils n’interviennent pas dans la réaction), Na+ (apportés en
même temps que les ions hydroxyde)
· A
l’équivalence : les ions hydroxyde ont été introduits en égale quantité avec
les ions H3O+ : ces deux ions ont été complètement
consommés, ils ne sont plus présents dans le milieu.
Contenu du bécher :
Cl-, Na+
· Après l’équivalence : On
ajoute la solution d’hydroxyde de sodium. Les ions hydroxyde ne peuvent plus
réagir avec l’ion H3O+ qui n’est plus présent. Les ions
hydroxyde et Na+ s’accumulent dans le milieu.
Contenu du bécher : Na+, HO-
, Cl- .
EXERCICES
EXERCICE I :
1.Quel
volume de chlorure d’hydrogène, mesuré dans les conditions ou le volume molaire
vaut 24 l faut-il dissoudre dans l’eau pour obtenir 1l de solution de
concentration 0,05 mol.l-1.
2.
Il faut verser 25 cm3 de cette solution dans 20 cm3 d’une
solution d’hydroxyde de sodium pour atteindre l’équivalence acido-basique.
2.1-Calculer
la concentration de la solution basique
2.2-Calculer
la masse du chlorure de sodium obtenue en évaporant l’eau de la solution.
2.3-Calculer
la masse de pastilles de soude nécessaires à la préparation de 100 cm3
de la solution basique
EXERCICE II :
1.On
verse progressivement une solution d’hydroxyde de sodium de concentration 0,1 mol.l-1, dans 20 cm3 d’acide
chlorhydrique de concentration 0,1 mol.l-1.
Calculer le pH à 25 C, de la solution contenue dans l’erlenmeyer, après avoir
ajouté successivement 1 ; 19 ; 19,9 et 20,1 cm3 de
solution basique.
2.
a-Quelle masse de cristaux d’hydroxyde de sodium faut-il
dissoudre dans l’eau pour obtenir 1 l de solution de concentration 0,15 mol.l-1 ?
b-Quel volume d’acide chlorhydrique, de concentration 0,2 mol.l-1 , faut-il pour réagir complètement sur 100 cm3
de la solution basique ?
c-Quelle est la masse du chlorure de sodium obtenu après
évaporation de l’eau de la solution ?
EXERCICE III :
On
dispose d’acide chlorhydrique concentré de concentraton12 mol-1.
1.Quel
volume d’acide concentré faut-il pour préparer :
-100
cm3 de solution à 0,2 mol.l-1
-1000
cm3 de solution à 0,75 mol.l-1 ?
2.Quel
volume d’eau distillée faut-il ajouter à 100 cm3 de la solution à
0,2 mol.l-1 pour avoir une solution de concentration 0,15
mol.l-1 ?
3.Pour
atteindre l’équivalence, il faut verser 15,7 cm3 de la solution
précédente dans 20 cm3 d’une solution d’hydroxyde de sodium, de
concentration inconnue.
3.1-Calculer
la concentration des ions sodium dans la solution obtenue.
3.2-Determiner la quantité en mol de nitrate d’argent
nécessaire pour précipiter tous les ions chlorure de la solution
CORRIGES
EXERCICE I :
1. Volume de chlorure d’hydrogène
Quantité de matière: n=CV=0,05x1=0,05 mol
n=V/Vm=>V=nVm=0,05x24=1,2 l
//Le chlorure d’hydrogène est à l’état gazeux.
2.
2.1-Calcul de la concentration de la solution basique
A l’équivalence, CaVa=CbVb =>Cb= CaVa/Vb=0,05x25/20=0.0625 mol.l-1.
2.2-Calcul de la masse du chlorure de sodium obtenue en évaporant
l’eau de la solution.
HCl +NaOH→NaCl +H2O
M(NaCl) =23+35,5=58,5
n(NaCl)=[Na+]xVb=0,0625x20.10-3=1,25.10-3
mol
n(NaCl)=m(NaCl)/M(NaCl) => m(NaCl)= n(NaCl)x M(NaCl) =1,25.10-3x58,5=7,3.10-2 g
2.3-Calcul de la masse de pastilles de soude
n(NaOH) =m(NaOH) /M(NaOH) =>m(NaOH) =n(NaOH) xM(NaOH) =CbVbM(NaOH) =0,0625x0,1x40=0,25 g
EXERCICE II :
1.na=0,1x20.10-3=2.10-3 mol d’acide initial.
Vb=1 cm3
Nombre de moles de HO- consommées : nb= CbVb=0,1x1.10-3 mol // L’ion hydroxyde est consommé
au fur et à mesure qu’il est introduit. L’ion H3O+ réagit
partiellement avec l’ion hydroxyde, il en reste en solution.
Nombre de moles de H3O+ restants : na =2.10-3
-0,1.10-3=1,9.10-3mol
Soit une
concentration Ca= na /Va+Vb
=1,9.10-3/21.10-2=0.09047=> =>pH=-log0,0905=1 // pH=-logCa
Vb=19 cm3
Nombre de moles de HO- consommées : nb= CbVb=0,1x19.10-3=1,9.10-3 mol // L’ion
hydroxyde est consommé au fur et à mesure qu’il est introduit. L’ion H3O+
réagit partiellement avec l’ion hydroxyde, il en reste en solution
Nombre de moles de H3O+ restants : na
= 2.10-3 -1,9.10-3=0,1.10-3mol
Soit une
concentration Ca= na /Va+Vb
=0,1.10-3/39.10-3=0.00256=> =>pH=-log0,00256=2,6 // pH=-logCa
Vb=19,9 cm3
Nombre de moles de HO- consommées (non consommées) :
nb= CbVb=0,1x19,9.10-3=1,99.10-3
mol// L’ion hydroxyde est consommé au fur et à mesure qu’il est
introduit. L’ion H3O+ réagit partiellement avec l’ion hydroxyde, il
en reste en solution
Nombre de moles de H3O+ restants : na
= 2.10-3 -1,99.10-3=0,01.10-3mol
Soit une concentration Ca= na /Va+Vb =0,01.10-3/39,9.10-3=0.0002506=>
=>pH=-log0,000256=3,6 // pH=-logCa
Vb=20,1 cm3
Nombre de moles de HO-
apportées : nb= CbVb=0,1x0,1.10-3=0,01.10-3
mol
// Après l’équivalence : On ajoute la
solution d’hydroxyde de sodium. Les ions hydroxyde ne peuvent plus réagir avec
l’ion H3O+ qui n’est plus présent. Les ions hydroxyde
s’accumulent dans le milieu.
Nombre de moles de H3O+ restants : 0
Soit une concentration Cb=nb/Va+Vb=0,01.10-3/40,1.10-3=0.00025=>
=>pH=14+log0,00025=14-3,6=10,4. //pH=14+logCb
Remarque : On constate un saut de pH après l’équivalence (Vb=20 cm3).
2.
a- Masse de cristaux d’hydroxyde de sodium
m=CbVM=0,15x1x40=6
g.
b- volume d’acide chlorhydrique
CaVa=CbVb =>Va= CbVb/Ca=0,15x0,1/0,2=75
cm3.
c- masse du chlorure de sodium obtenu
n(NaCl)=[Na+]xVb=0,15x0,1=0,015 mol
n(NaCl)=m(NaCl)/M(NaCl) => m(NaCl)= n(NaCl)x M(NaCl) =0,015x58,5=0,88
g.
EXERCICE III:
1. Volume d’acide concentre qu’il faut :
-100 cm3 de solution a 0,2 mol.l-1
C1V1=C2V2 =>V1=
C2V2/C1=0,2x100/12=1,7 cm3 //on fait
juste une dilution
-1000 cm3 de solution à 0,75 mol.l-1
C1V1=C2V2 =>V1=
C2V2/C1=0,75x1000/12=62,5 cm3
2. Volume d’eau distillée qu’il faut ajouter
C1V1=C2(V2+100) =>V2+100=
C1V1/C2=0,2x100/0,15=133,33 cm3
=> V2=33,3 cm3.
3..
3.1-Calcul de la concentration des ions sodium dans la solution
obtenue.
na=CaVa=0,15x15,7,10-3=2,355.10-3 mol
na=nb <
=> nb= CbVb=2,355 =>Cb=2,355/35,7=0,066 mol.l-1
3.2-Quantité en mol de nitrate d’argent nécessaire pour précipiter
tous les ions chlorure de la solution.
nCl-=[Cl-]xVa=0,15x15,7=2,355.10-3 mol
Ag+ +Cl- -→ AgCl
nAg+=nCl-=2,355.10-3
mol=2,4.10-3 mol //La réaction se fait mole a mole.
Avez-vous
un exercice a proposer?Cliquez-ici
Merci de votre visite
Laissez un commentaire