CLASSIFICATION PERIODIQUE DES ELEMENTS
Tous les éléments sont groupés dans
un tableau qui est le tableau de classification périodique des éléments.
L’élément est représenté par :
A : nombre de masse, il désigne le nombre de protons plus le nombre de
neutrons.
Z : numéro atomique ou nombre de charge, il désigne le nombre de protons.
N : nombre de neutrons.
Donc,
nous aurons, pour un élément de nombre de masse A et de numéro atomique Z la
représentation suivante :
![]()
Remarque :
Dans un atome, le numéro
atomique Z est aussi égal au nombre d’électrons (lorsque l’atome est ionisé,
c’est différent).
Principe de
classification
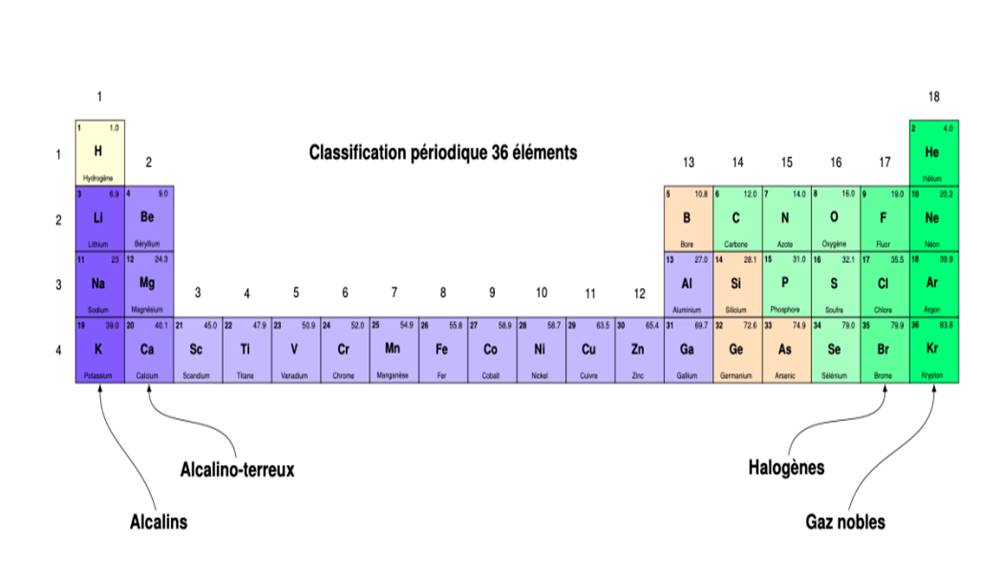
Les éléments, représentés par leurs
symboles, sont classés par ordre de numéro atomique croissant dans un
tableau à 18 colonnes ou groupes et 7 lignes ou périodes. Chaque
élément occupe une case du tableau. Son numéro atomique est situé en haut et à
gauche de la case.
-Le groupe de la colonne I est le groupe des
alcalins : A l’exception de l’hydrogène, ce sont les alcalins (lithium,
sodium, potassium,)
-Le groupe de la colonne 17est le groupe des
allogènes : périphériques (fluor, chlore, brome, iode…)
-Le groupe de la colonne 18 est le groupe des gaz
rares : (hélium, néon, argon, krypton).
Intérêt de la
classification périodique des éléments
Elle fournit des renseignements importants sur chaque
élément chimique :
-son symbole X (au milieu de la case)
-son numéro atomique Z (à gauche et en haut de la
case).
-son nombre de masse (à droite et en haut de la case).


EXERCICES
EXERCICE I : Recopie et complète les phrases suivantes :
1. Le…………..d’un élément chimique est le nombre Z qui le caractérise.
2. Dans la classification périodique, les éléments
sont rangés de la…………..vers la………….par ordre de numéro atomique Z croissant.
3. Le tableau simplifié de classification
comporte…………colonnes et ………….lignes.
4. Les lignes sont encore appelés …………….et les
colonnes …………..
5. Dans la classification périodique chaque élément
occupe une seule……………..
EXERCICE II : Complète le tableau suivant
à l’aide des renseignements que tu
retrouveras dans la case occupée par chacun des éléments :
|
Nom de l’élément |
|
Carbone |
Azote |
Chlore |
|
Calcium |
|
Symbole |
|
C |
|
Cl |
|
Ca |
|
Numéro atomique (Z) |
2 |
|
|
|
13 |
|
|
Masse molaire atomique (g.mol-1) |
|
|
14.0 |
|
|
|
EXERCICE III : L’élément sodium a pour
numéro atomique Z=11.A partir du tableau de classification périodique des
éléments, réponds aux questions suivantes :
1. Quel est son symbole ?
2. Situe-le dans le tableau de classification
simplifié.
3. Quels sont le numéro atomique, le nom, le symbole
et la situation dans le tableau simplifié de :
a) L’élément situé directement au-dessus de sa
case ?
b) L’élément situé directement en-dessous de sa
case ?
c) L’élément situé à deux cases avant la sienne ?
d) L’élément qui le suit dans le tableau ?
4. Quelle est la masse molaire atomique de l’élément
sodium.
SOLUTIONS :
EXERCICE I :
1. Le numéro atomique d’un élément
chimique est le nombre Z qui le caractérise.
2. Dans la classification périodique, les
éléments sont rangés de la gauche vers la droite par ordre de
numéro atomique croissant.
3. Le tableau simplifié de classification
comporte 8 colonnes et 4 lignes.
4. Les lignes sont encore appelées période.et
les colonnes groupes.
5. Dans la classification périodique chaque
élément occupe une seule case.
EXERCICE II :
|
Nom de l’élément |
Hélium |
Carbone |
Azote |
Chlore |
Aluminium |
Calcium |
|
Symbole |
He |
C |
N |
Cl |
Al |
Ca |
|
Numéro atomique (Z) |
2 |
6 |
7 |
17 |
13 |
20 |
|
Masse molaire atomique (g.mol-1) |
4.0 |
12.0 |
14.0 |
35,5 |
27 |
40,1 |
EXERCICE III :
1. Na
2. 1ère colonne,3ème
ligne.
3.
a) Numéro atomique : 3
Nom: Lithium
Symbole : Li
Situation : 1ère colnne, 2ème ligne.
b) Numéro atomique : 19
Nom: Potassium
Symbole : K
Situation : 1ère colonne ,4ème ligne.
c) Numéro atomique :9
Nom:Fluor
Symbole : F
Situation : 17ème colonne ,2ème ligne.
d) Numéro atomique : 12
Nom: Magnésium
Symbole :Mg
Situation : 2ème colonne, 3ème ligne.
4. masse molaire atomique de l’élément
sodium : 23.0
Avez-vous
un exercice a proposer?Cliquez-ici
Merci de votre visite
Laissez un commentaire