REACTION ACIDE-BASE
DEFINITIONS
Une réaction acide- base est une réaction chimique dans laquelle
l’acide d’un couple
réagit avec la base d’un autre couple.
Si l’acide du couple acide1/base1 réagit
avec la base du couple acide2/base2,
alors la réaction acido-basique s’écrit :
acide1
+ base2 ⇆ base1+ acide2
Exemple : couples CH3COOH/ CH3COO-
et H3O+/H2O.
CH3COOH + H2O ⇆ CH3COO- + H3O+
acide 1. Base 2. Base 1 Acide 2
Espèce
amphotère
Une espèce est dite amphotère si elle correspond à l’acide d’un couple
et à la base d’un
autre couple.
Exemple :
• L’eau est l’acide du couple H2O/HO–
HO- + H+
⇆ H2O
• L’eau est la base du couple H3O+/H2O.
H3O+ ⇆ H2O + H+
La molécule d’eau qui se comporte tantôt comme
un acide et tantôt comme une base est un amphotère ou ampholyte.
En effet, lorsqu’on met en solution un acide ou une base, il se crée toujours
une interaction entre deux couples acide/base dont l’un est nécessairement un
couple de l’eau.
REACTION ACIDE FORT -BASE FORTE
.
Les acides forts cèdent complètement leur proton acide lorsqu’ils sont
dissous dans l’eau.
-Cette réaction est exothermique.
Cette
réaction qui est totale apparaît comme un transfert de proton (H+)
de l’ion H3O+ à l’ion HO-.
Exemple : Réaction entre HCl et NaOH
On
a en solution :
HCl
+H2O→H3O+ +Cl-
L’ion
Cl- ,
base conjuguée de l’acide HCl est un ion indifférent dans l’eau (ne
participe pas à la réaction acido-basique).
La
base conjuguée d’un acide fort est une espèce chimique indifférente dans l’eau
On a en solution :
NaOH→Na+
+HO-
L’ion Na+, acide conjugué de la base NaOH est un ion
indifférent dans l’eau (ne participe pas à la réaction acido-basique).
L’acide
conjugué d’une base forte est une espèce chimique indifférente dans l’eau
L’équation-bilan
de la réaction d’un acide fort avec une base forte s’écrit :
H3O+ + HO- → 2H2O
REACTION ACIDE FAIBLE –BASE FORTE
. Les acides faibles dans l’eau ne
sont pas totalement hydrolysés : ils ne cèdent qu’une partie de leurs protons
acides à l’eau.
-Elle est exothermique
-Elle
est quasi totale
Exemple : Réaction entre
l’acide éthanoïque et l’hydroxyde de sodium
CH3COOH+(Na+ + HO-) → (CH3COO- +Na+) + H2O
REACTION ACIDE FORT –BASE FAIBLE
-Elle
est quasi-totale
Exemple : Réaction entre
l’acide chlorhydrique et l’ammoniac
H3O+ +
NH3 →H2O
+ NH4+
SOLUTIONS
TAMPONS
Une solution tampon est une solution qui résiste
aux variations de son pH lorsqu’on y ajoute un acide ou une base.
Le
pH de cette solution est donc peu sensible aux additions modérées d’acide ou de
base.
Une solution tampon est
généralement constituée de deux composants principaux : Un acide faible
et sa base conjuguée (ou inversement, une base faible et son acide
conjuguée). Ces deux composants interagissent pour neutraliser les ajouts
d’acides (H+) ou de bases (HO-)
Lorsqu’un
acide est ajoute à la solution, l’anion de la base conjuguée (comme l’acétate)
capte les ions H+, ce qui évite une chute importante du pH.
Lorsqu’une
base est ajoutée, l’acide faible (comme l’acide acétique) libère des ions H+
pour neutraliser les HO-, ce qui empêche l’augmentation du pH.
Exemples :
Tampon
acide : Une solution tampon peut être composée de l’acide acétique (CH3COOH)
et de l’acétate de sodium (CH3COONa), Il a un pH autour de 4,75.
Tampon
basique : Ammoniac (NH3) et Chlorure d’ammonium (NH4Cl).
Il a un pH autour de 9,25.
EXERCICES
EXERCICE I :
1.Ecrire les équations des réactions suivantes :
a) acide benzoïque(𝐶6𝐻5𝐶𝑂𝑂𝐻) et ion fluorure.
b) acide formique (HCOOH) et ion hypochlorite.
c) acide chlorique (HClO3 ) et ion dichloroéthanoate (CHCl2COO-).
d) acide iodoéthanoïque (CH2ICOOH) et ion fluorure.
e) acide perchlorique et ion hydroxyde.
f) acide chlorhydrique (CH2ICOOH) et ion chlorate.
2.Lesquelles peuvent être considérées comme
complètes, incomplètes ?
EXERCICE II :
Quels sont les réactions qui se déroulent quand on
mélange les solutions suivantes ? Calculer aussi le pH obtenu.
a) 500 ml HCl 0,10 mol.l-1 et 500 ml NaOH 0,050 mol.l-1
b) 500 ml HCl 0,10mol.l-1 et 100 ml NH3 0,20 mol.l-1
c) 500 ml HCl 0,10 mol.l-1 et 500 ml NaOH 0,10 mol.l-1
d) 500 ml CH3COOH 0,10 mol.l-1 et 500 ml NaOH 0,20 mol.l-1
EXERCICE III :
On dispose d’une solution SA d’acide
nitrique de concentration CA=2,0.10-2 mol/l et d’une
solution SB obtenue par dissolution de 1,0 g d’hydroxyde de sodium
dans 1 l d’eau.
1.Determiner la concentration CB de la
solution basique.
2.Determiner le volume de la solution SB
qu’il faut ajouter à 200 ml de solution SA pour obtenir une solution
de pH=7.0.
EXERCICE IV :
1.1-
Dans le couple 𝑁𝐻4 + ⁄ 𝑁𝐻3, quel est l’acide, quelle est la base ? Nommer
les.
1.2-
Ecrire la demi-équation acido-basique associée à ce couple.
2-
Réaction acido-basique :
2.1-
- Quelle est la base conjuguée de l’acide éthanoïque ?
2.2-
Quel est l’acide conjugué de l’ion hydroxyde 𝑂𝐻− ?
2.3-
Ecrire la réaction acido-basique entre l’acide éthanoïque et l’ion hydroxyde.
EXERCICE V :
1- Donner le couple 𝑎𝑐𝑖𝑑𝑒⁄𝑏𝑎𝑠𝑒, et la demi-équation acido-basique.
a-
L’acide acétique 𝐶𝐻3𝐶𝑂𝑂𝐻.
b-
La base ammoniac 𝑁𝐻3.
2- En déduire
l’équation de la réaction qui se produit entre ces deux espèces.
3- Quelle est la composition, en concentrations, de
la solution obtenue lorsqu’on introduit des quantités
𝑛1 = 12,0 𝑚𝑚𝑜𝑙 d’acide acétique et 𝑛2 = 14,5 𝑚𝑚𝑜𝑙 d’ammoniac dans l’eau distillée de manière à obtenir un volume 𝑉 = 250,0 𝑚𝐿 de solution.
EXERCICE VI :
L’acide benzoïque 𝐶6𝐻5𝐶𝑂𝑂𝐻 et le benzoate de
sodium 𝐶6𝐻5𝐶𝑂𝑂𝑁𝑎 sont utilisés comme conservateurs,
notamment dans les boissons dites « light ». Ils portent les codes respectifs
E210 et E211.
1-
Ecrire l’équation de dissolution du benzoate de sodium dans l’eau.
2-
Identifier le couple 𝑎𝑐𝑖𝑑𝑒⁄𝑏𝑎𝑠𝑒 mettant en jeu l’acide
benzoïque et écrire la demi-équation acidobasique correspondante.
3-
On fait réagir une masse 𝑚 = 3,00 𝑔 d’acide benzoïque avec
150 𝑚𝐿 d’une solution
d’hydroxyde de sodium de concentration 𝐶 = 2,50.10 −1𝑚𝑜𝑙. 𝐿 −1 .
3.1-
Identifier les couples 𝑎𝑐𝑖𝑑𝑒⁄𝑏𝑎𝑠𝑒 mise en jeu, puis
écrire l’équation de la réaction envisagée.
3.2-
Etablir un tableau d’avancement et déterminer maximal de la réaction. Quel est
le réactif limitant ?
EXERCICE VII :
On
ajoute les réactifs suivants. Indiquer dans quel cas on aboutit à un mélange
tampon et pourquoi.
a) 50 ml CH3COOH 0,050 mol.l-1 et 50 ml CH3COONa
0,05 mol.l-1
b) 50 ml CH3COOH 0,050 mol.l-1 et 50 ml NaOH 0,10 mol.l-1
c) 50 ml CH3COOH 0,050 mol.l-1 et 50 ml NaOH 0,010 mol.l-1
d)
1 litre H Cl 0,050 mol.l-1 et
6,80 g HCOONa pur
e)
1 litre H Cl 0,050 mol.l-1 et
4,40 g HCOOH pur
CORRIGES
EXERCICE I :
a) C6H5COOH + F-
⇆C6H5COO- + HF (incomplète)
b) HCOOH + ClO- →HCOO-
+ HClO (complète.)
c) HClO3 + CHCl2COO- ⇆ClO3 - + CHCl2COOH (incomplète)
d) CH2ICOOH + F- ⇆CH2ICOO- + HF (incomplète)
e) H3O+ + OH- →H2O
+ H2O (complète)
f) H3O+ + ClO3 -⇆ H2O + HClO3 (incomplète )
EXERCICE II :
a) pH = 1,60
H3O+ + Cl- +
(Na+
+HO-) → H3O+ +
HO-
+ (Na+ + Cl-)
Il y a formation du sel : (Na+ + Cl-) chlorure de sodium
na=CaVa=0,1x0,5=0,05
mol nombre de moles d’acide
nb=CbVb=0,05x0,5=0,025
mol , nombre de moles de base
La réaction se faisant mole a mole, il restera dans la solution
après neutralisation n’a=0,5-0,025=0,025 mol
[H3O+]=0,025/1=0,025
mol/l =>pH=-log0,025=1,60
b) pH
= 1,30
H3O+ + Cl- +
(NH4+
+HO-) → H3O+ +
HO-
+ (NH4+ + Cl-)
Il y a formation du sel : (NH4+ + Cl-) chlorure d’ammonium
na=CaVa=0,1x0,5=0,05
mol nombre de moles d’acide
nb=CbVb=0,2x0,1=0,02
mol , nombre de moles de base
La réaction se faisant mole a mole, il restera dans la solution
après neutralisation n’a=0,05-0,02=0,03 mol
[H3O+]=0,03/0,6==0,05
mol/l =>pH=-log0,05=1,30
c) pH
= 7,00
H3O+ + Cl- +
(Na+
+HO-) → H3O+ +
HO-
+ (Na+ + Cl-)
Il y a formation du sel : (Na+ + Cl-) chlorure de sodium
na=CaVa=0,1x0,5=0,05
mol nombre de moles d’acide
nb=CbVb=0,1x0,5=0,05
mol , nombre de moles de base
La réaction se faisant mole a mole, il restera dans la solution
après neutralisation n’a=0,05-0,05=0 mol
La solution est neutre
d) pH = 12,70
H3O+ + CH3COO- +
(Na+
+HO-) → H3O+ +
HO-
+ (Na+ +
CH3COO-)
Il y a formation du sel : (Na+ + CH3COO-)
na=CaVa=0,1x0,5=0,05
mol nombre de moles d’acide
nb=CbVb=0,2x0,5=0,1
mol , nombre de moles de base
La réaction se faisant mole a mole, il restera dans la solution
après neutralisation n’b=0,1-0,05=0,05 mol
[HO-]=0,05
[H3O+]=10-14/0,05=20.10-14
mol/l =>pH=14+log0,05=12,7.
EXERCICE
III :
1. Déterminer la concentration CB de la base
NaOH : masse
molaire M = 23 + 16 + 1 = 40 g/mol
n = m / M = 1,0 / 40 = 0,025 mol dans
1 L
Donc :
CB = 0,025 mol / 1 L = 2,5 × 10⁻² mol/L
2. Déterminer le volume Vb nécessaire pour
neutraliser 200 mL de SA
Réaction : HNO₃ + NaOH → NaNO₃ + H₂O
(Stœchiométrie 1:1)
Quantité de matière d'acide :
nₐ = Cₐ × Vₐ = (2,0
× 10⁻²) × 0,200 =
4,0 × 10⁻³ mol
On veut neutralisation totale ⇒ n_b = nₐ
Donc :
nb = CB × Vb ⇒ Vb = nb /
CB
Vb = (4,0 × 10⁻³) / (2,5 × 10⁻²) = 0,160 L = 160 mL
//1.Concentration
CB de la solution basique.
CB=m/MV=1/40x1=0,025 mol/l
2.CBVB=CA/VA
=>VB=CAVA/CB=200.x2.10-2/25.10-3=160
ml
EXERCICE IV :
1-Couple 𝑎𝑐𝑖𝑑𝑒⁄𝑏𝑎𝑠𝑖𝑞𝑢𝑒 :
1.1- Dans le couple 𝑁𝐻4 +
⁄ 𝑁𝐻3:
𝑁𝐻3 : ammoniac,
c’est une base
𝑁𝐻4 +
: ion ammonium, c’est un acide.
1.2- Demi-équation acido-basique :
𝑵𝑯𝟑 + 𝑯+ ⇄ 𝑵𝑯𝟒+
2- Réaction acido-basique :
2.1- L’ion éthanoate 𝐶𝐻3𝐶𝑂𝑂 − est
la base conjuguée de l’acide éthanoïque 𝐶𝐻3𝐶𝑂𝑂𝐻.
2.2- La molécule d’eau 𝐻2𝑂 est l’acide conjuguée de l’ion 𝑂𝐻−.
2.3- Réaction acido-basique :
𝑪𝑯𝟑𝑪𝑶𝑶𝑯 + 𝑶𝑯− ⟶ 𝑪𝑯𝟑𝑪𝑶𝑶 −
+ 𝑯𝟐𝑶
Cette réaction est de la forme 𝑎𝑐𝑖𝑑𝑒 1 + 𝑏𝑎𝑠𝑒 2 ⟶ 𝐵𝑎𝑠𝑒 1 + 𝑎𝑐𝑖𝑑𝑒 2
EXERCICE V :
1- le couple 𝑎𝑐𝑖𝑑𝑒⁄𝑏𝑎𝑠𝑒 :
a-
L’acide acétique 𝐶𝐻3𝐶𝑂𝑂𝐻 :
𝐶𝐻3𝐶𝑂𝑂𝐻/ 𝐶𝐻3𝐶𝑂𝑂 −
b-
b- La base
ammoniac 𝑁𝐻3 :
𝑁𝐻4 +⁄𝑁𝐻3
La demi-équation
acido-basique :
𝑪𝑯𝟑𝑪𝑶𝑶𝑯 ⇄ 𝑪𝑯𝟑𝑪𝑶𝑶 −
+ 𝑯+
𝑵𝑯𝟑 + 𝑯+ ⇄ 𝑵𝑯𝟒 +
2- L’équation de la réaction acido-basique :
𝑪𝑯𝟑𝑪𝑶𝑶𝑯 + 𝑵𝑯𝟑 ⟶ 𝑪𝑯𝟑𝑪𝑶𝑶 −
+ 𝑵𝑯𝟒 +
3- La composition, en
concentrations :
Tableau d’avancement :

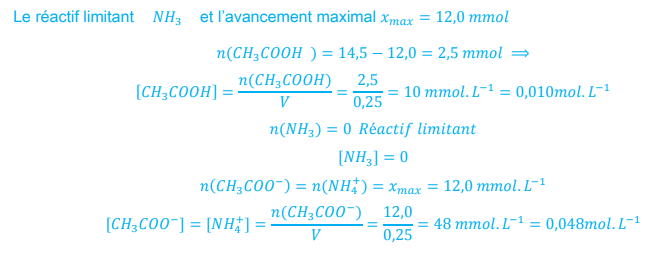
EXERCICE VI :
1-
Equation de dissolution du benzoate de sodium :
𝑪𝟔𝑯𝟓𝑪𝑶𝑶𝑵𝒂(𝒔) 𝒆𝒂𝒖 → 𝑵𝒂(𝒂𝒒) + + 𝑪𝟔𝑯𝟓𝑪𝑶𝑶(𝒂𝒒) −
2- Le couple 𝑎𝑐𝑖𝑑𝑒⁄𝑏𝑎𝑠𝑒 de l’acide
benzoïque : 𝐶6𝐻5𝐶𝑂𝑂𝐻 /𝐶6𝐻5𝐶𝑂𝑂 −
3.1-
Identifier les couples 𝑎𝑐𝑖𝑑𝑒⁄𝑏𝑎𝑠𝑒 mise en jeu
:
La solution
d’hydroxyde de sodium est constituée d’ion 𝑁𝑎+ et d’ion 𝑂𝐻−.
Le couple acide base qui intervient est ici 𝐻2𝑂/ 𝑂𝐻−
L’autre
couple est évidemment 𝐶6𝐻5𝐶𝑂𝑂𝐻/ 𝐶6𝐻5𝐶𝑂𝑂 −
Les
demi-équations puis l’équation globale :

L’acide
benzoïque 𝐶6𝐻5𝐶𝑂𝑂𝐻 est le réactif limitant
EXERCICE VII :
a) tampon
acide faible + sa base conjuguée de
concentrations voisines
b) pas de tampon
acide faible + base forte
Il y a plus de NaOH (base forte) que
d’acide acétique dans le mélange :
-0,025 mol d’acide acétique réagiront avec 0,025 mol de NaOH
-il restera donc 0,05-0,025=0,025 mole de NaOH
excédentaire.
l’excès NaOH : (pH
= 12,40) rend la solution basique, ce qui ne correspond pas aux conditions
nécessaires pour qu’une solution tampon fonctionne
c) tampon
(tout
NaOH réagit pour former de l’acétate de sodium, il
reste de l’acide acétique)
d) tampon (tout HCl réagit pour former de
l’acide formique, il reste du formiate)
e) pas de tampon (deux acides)
Avez-vous
un exercice a proposer?Cliquez-ici
Merci de votre visite
Laissez un commentaire